
X | Y | |
Z | W |







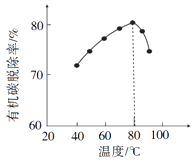
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
①该反应体现出酸性关系: H3PO4 H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,。
A的单质是密度最小的物质;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C的原子最外层电子数是其内层电子数的三倍;D与B同周期,该周期中D的简单离子半径最小;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分;F元素最高正价与最低负价的代数和为4.


请回答下列问题:
a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.NO中N为+2价,O为﹣2价 d.碱性:NH3>H2O.
已知:H2CO3=4.3×10﹣7 =5.6×10﹣11 .

仪器A的名称为,干燥管D的作用是.