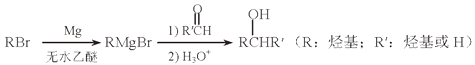
依据上述信息,写出制备 ![]() 所需醛的可能结构简式:。
所需醛的可能结构简式:。

a.碳链异构
b.官能团异构
c.顺反异构
d.位置异构

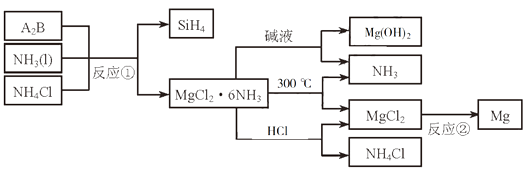
该路线中试剂与条件1为,X的结构简式为;
试剂与条件2为,Y的结构简式为。
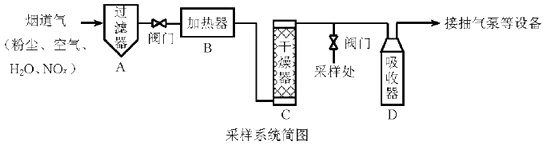
a.碱石灰
b.无水CuSO4
c.P2O5

将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2 , 在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是。

电池的负极反应式:。
电池的正极反应式:6O2+6e−=6O2−
6CO2+6O2−=3C2O42−
反应过程中O2的作用是。
该电池的总反应式:。