由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 |
|
|
|
|
A | B | C | D |
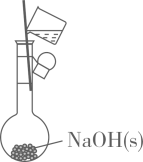 配制
配制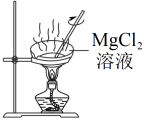 制备无水氯化镁
C .
制备无水氯化镁
C . 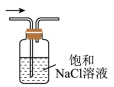 除去
除去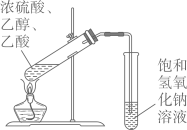 制备乙酸乙酯
制备乙酸乙酯
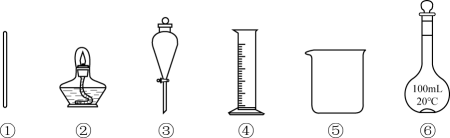
| A | B | C | D |
| | | | |
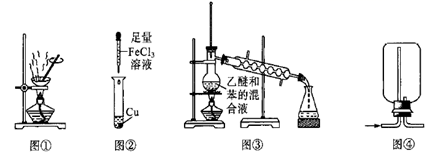
| 蒸发浓缩制NaCl | 制备SO2气体 | 用KMnO4滴定Na2C2O4 | 观察铁的析氢腐蚀 |
 B .
B .  C .
C .  D .
D . 
 B . 制备硝基苯
B . 制备硝基苯 C . 精制
C . 精制 D . 分离硝基苯
D . 分离硝基苯
A | B | C | D |
|
|
|
|
烧杯 | 酒精灯 | 坩埚 | 漏斗 |
|
A |
B |
C |
D |
|
|
|
|
|
|
制备SO2 |
制备CuCl |
干燥CuCl |
吸收SO2尾气 |

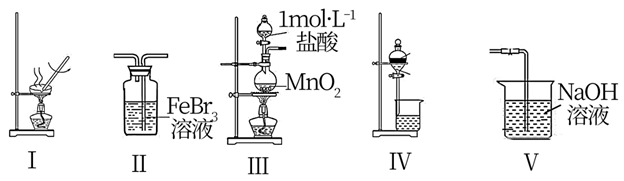
| 选项 | A. | B. | C. | D. |
| 实验操作 | | | | |
| 实验目的 | 制取氨气将其溶于饱和食盐水 | 用碳酸钠与稀硫酸制二氧化碳 | 过滤获得碳酸钠晶体 | 蒸发浓缩氯化铵溶液 |


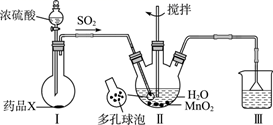
| 选项 | A | B | C | D |
| 实验装置 | | | | |
| 实验目的 | 用NaOH标准液滴定盐酸(锥形瓶中) | 除去CO2气体中混有的HCl杂质 | 由CuSO4溶液制取胆矾 | 检查装置气密性 |


时相关物质的参数如下:
的溶解度:
化合物 | |

回答下列问题:
Ⅰ.取已知浓度的溶液,搅拌下滴加足量
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量
固体,制得
和
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:


回答下列问题:



已知:①草酸( )是一种二元弱酸,不稳定易分解,具有还原性。
②常温时,有关物质 如下表(单位已略):
| | | | | | | | | |
| | | | | | | | | |
③当离子浓度 ,可认为沉淀完全。
④常温下 的溶解度为
,
的溶解度随温度的升高而逐渐减小。
回答下列问题:

已知:
①.P204萃取剂易萃取 、
;P507萃取剂易萃取
。
②.pH=3.5, 的溶解度随温度升高而增大。
回答下列问题:


已知:
i.粗铜粉与气体完全反应。
ii.部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为计算)。
离子 | 开始沉淀的pH | 完全沉淀的pH |
1.1 | 3.2 | |
4.4 | 6.4 |

设计简单实验,证明溶液中有上述转化关系。
a.用托盘天平称取一定质量氯化铜晶体。
b.在坩埚中充分灼烧。
c.在(填仪器名称)中冷却。
d.称量所得黑色固体质量。
e.重复b~d操作直至。

已知:①有关物质在水和乙醇中的溶解性:
|
葡萄糖酸钙 |
葡萄糖酸锌 |
硫酸锌 |
硫酸钙 |
|
|
水 |
可溶于冷水,易溶于热水 |
易溶 |
微溶 |
|
|
乙醇 |
微溶 |
难溶 |
||
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTAl0.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为。
②该粗产品中Zn的质量分数为。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管

可能用到的数据如下:不同金属离子沉淀的pH
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全pH |
3.7 |
9.7 |
9.8 |
硫酸锰在不同温度下的溶解度表
|
温度/℃ |
50 |
80 |
90 |
100 |
|
溶解度1(g/100g水) |
58 |
48 |
42 |
34 |


已知:①T.f细菌在1.0<pH<6.0范围内保持生物活性。
②几种离子形成氢氧化物沉淀的pH如表所示:
|
Fe3+ |
Fe2+ |
Cu2+ |
|
|
开始沉淀时的pH |
1.9 |
7.0 |
4.2 |
|
完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
回答下列问题:
A.化合物 B.硫酸盐 C.混合物 D.复盐
为了提高生物堆浸速率,上述流程采用的措施是。
①CuFeS2+4H++O2=Cu2++Fe2++2S+2H2O;②(补充离子方程式)。
这两个过程中的能量变化如图所示,其中控制生物堆浸总速率的是 (填“①”或“②")。生物堆浸过程中应控制溶液pH的范围为。


已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |