由固体配制
溶液,下列仪器中需要使用的有(填序号)。

查阅资料:
已知:a.(深蓝色溶液)
b.(无色溶液)
(深蓝色溶液)
设计方案并完成实验:
实验 | 装置 | 试剂x | 操作及现象 |
A |
|
| 加入 |
B |
| 加入 |
现象分析与验证:
推测实验B产生的无色气体为 , 实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到。
①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量,观察到沉淀溶解,得到无色溶液,此反应的离子方程式为;露置在空气中一段时间,观察到溶液变为深蓝色。
①若假设合理,实验B反应的离子方程式为和。
②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形(补全实验操作及现象)。

硫酸铜溶液呈蓝色的原因是溶液中存在配离子(填化学式)。
|
实验操作 |
实验现象 |
有关离子方程式 |
|
|
滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐,得到深蓝色的透明溶液,滴加乙醇后析出色晶体 |
|
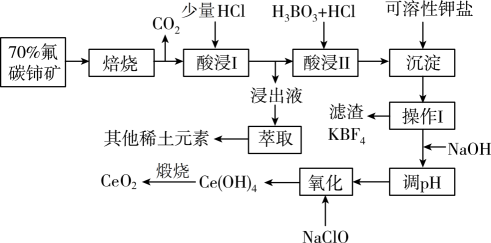
已知:①铈的常见化合价为、
。四价铈不易进入溶液,而三价铈易进入溶液
②能与
结合成
,
能被萃取剂
萃取。

①在该晶体中,铈离子的配位数为。
②阿伏加德罗常数的值为 ,
相对分子质量为M,晶体密度为
, 其晶胞边长的计量表达式为
nm。
①室温下,反应的
(用含
、
或
的代数式表示)。
②基态核外电子排布式为。
③室温下,初始浓度为的
溶液中
随
的变化如图所示。
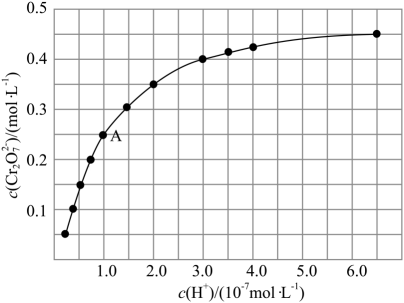
根据A点数据计算反应的
,下列关于该反应的说法不正确的是。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为 , 则
C.若升高温度,溶液中的平衡转化率减小,则该反应的
①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。时,Cr(Ⅵ)的去除率很低的原因是。

②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
得到电子转化为H,。


①该制备过程总反应的化学方程式为。
②电解一段时间后,阳极区溶液中的物质的量由
变成
, 则生成的重铬酸钾的物质的量为
。
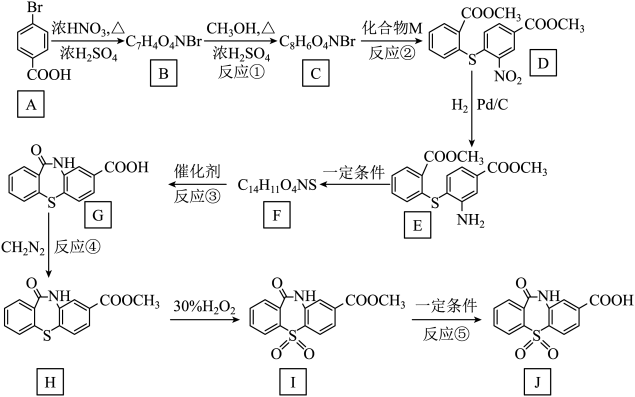
已知:
![]() , 回答下列问题:
, 回答下列问题:
①M中电负性最强的元素是。
②M与![]() 相比,M的水溶性更(填“大”或“小”)。
相比,M的水溶性更(填“大”或“小”)。
③与
性质相似,写出M与NaOH溶液反应的化学方程式。
a.能与溶液发生显色反应;b.能发生银镜反应;c.苯环上有2个取代基。其中核磁共振氢谱有五组峰,且峰面积之比为
的结构简式为。
 的路线(无机试剂任选)。
的路线(无机试剂任选)。