| 实验内容 | 实验目的 | |
| A | 向1mL 0.1mol•L-1NaOH溶液中加入2mL 0.1mol•L-1CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热后未出现红色沉淀 | 证明葡萄糖中不含醛基 |
| B | 向1mL 0.2mol•L-1AgNO3溶液中滴入2滴0.1mol•L-1KCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1KI溶液,又生成黄色沉淀 | 证明在相同温度下,Ksp(AgCl)>Ksp(AgI) |
| C | 室温下,用pH试纸测定同浓度的Na2CO3与NaClO的pH,比较二者pH的大小 | 证明碳元素的非金属性弱于氯 |
| D | 将FeCl2样品溶于盐酸,滴加KSCN溶液,溶液变红色 | 证明FeCl2样品已变质 |

| 过程(2)中溶液含有的离子 | 过程(3)中溶液含有的离子 | |
| 甲 | 既有 | 有 |
| 乙 | 有 | 有 |
| 丙 | 有 | 有 |

已知:滤液1和滤液2中钒以 的形式存在。回答下列问题:

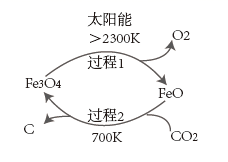
已知①
②
则过程2的热化学方程式为。
| 容器 | 起始物质的量 | | |||
| | | | | ||
| Ⅰ | 0.2 | 0.2 | 0 | 0 | 50% |
| Ⅱ | 0.2 | 0.1 | 0.2 | 0.3 | / |
容器Ⅰ在10min时反应达到平衡,该段时间内 的平均反应速率为
;容器Ⅱ起始时反应向(填“正反应方向”、“逆反应方向”或“不移动”)进行。
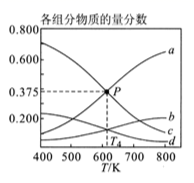
①图1中 、
、
最高的是。
②图2表示在总压为P的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。
温度时,列式表示该反应的压强平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。