化学式 | CH3COOH | HCN | H2CO3 |
K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
下列说法正确的是( )
氯化铜在不同温度下结晶形成的结晶水合物
温度 |
|
| ||
结晶水合物 |
回答下列问题:
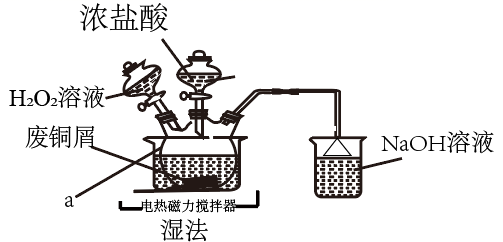
①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。

部分阳离子以氢氧化物形式沉淀时溶液
|
沉淀物 |
|
|
|
|
|
完全沉淀的 |
3.7 |
9.6 |
9.2 |
5.2 |
回答下列问题:
Ⅰ.
Ⅱ.
回答下列问题:

①温度为 , 经
体系达到平衡,则
的平均反应速率为,该温度下反应Ⅰ的平衡常数
。
②随着温度的升高,的平衡转化率增加但甲醇的选择率降低,分析其原因。


坐标 原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
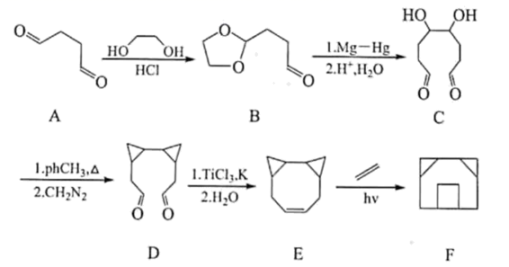
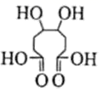 ,
, ①与溶液反应显紫色 ②
该物质最多消耗
③核磁共振氢谱有4组峰,且峰面积比为
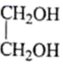 、
、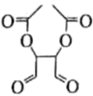 的合成路线。(其他无机试剂任选)
的合成路线。(其他无机试剂任选)