

步骤I. 的制备
 步骤Ⅱ.产品中
步骤Ⅱ.产品中 含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
;
④平行测定三次, 平均值为22.45,
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
| 温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| | 11.9 | 15.8 | 21.0 | 27.0 | |||
| | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
 C .
C .  D .
D . 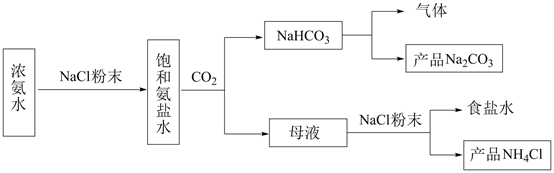
回答下列问题:
A. 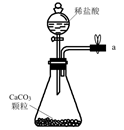 B.
B. 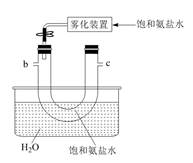 C.
C.  D.
D. 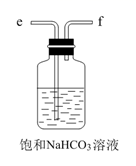 E.
E. 
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
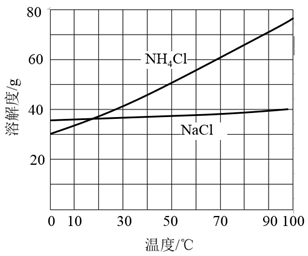
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。

已知:PFC样品的密度ρ = 1.40 g·mL−1 , 样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L−1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L−1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)。


① <3,反应液中产生少量气体,测氨仪未检出NH3 , 说明逸出的气体主要是(填化学式)。
②n[CO(NH2)2]/n(Fe3+)>12,溶液的pH处于稳定状态,这是因为
I.取镁铁水滑石3.300g加入足量稀硫酸充分反应,收集到气体112mL(标准状况)。
II.文献查得镁铁水滑石热分解TG-DSC图:303~473K,失去层间水(结晶水)失重为10.9%;473~773K时,CO32-和OH-分解为CO2和H2O;773K以上产物为MgO、Fe2O3。
Ⅲ.称取0.4000g热分解残渣(773K以上)置于碘量瓶中,加入稍过量盐酸使其完全溶解,加入适量水和稍过量的KI溶液,在暗处放置片刻,用0.1000mol·L-1Na2S2O3标准溶液滴定到溶液呈淡黄色,加入3mL淀粉溶液,继续滴定到溶液蓝色消失。(2Na2S2O3+I2=2NaI+Na2S4O6),消耗Na2S2O3溶液20.00mL。通过计算确定镁铁水滑石的化学式(写出计算过程)。
|
序号 |
起始读数/mL |
终点读数/mL |
|
1 |
0.00 |
12.10 |
|
2 |
1.26 |
13.16 |
|
3 |
1.54 |
14.64 |