| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L-1) | 0.80 | 0.40 | 0.20 | 0.10 | 0.050 |
下列说法错误的是( )
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有NO | 取少量该溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液 | 若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO |
| B | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol·L-1KI溶液于试管中,加入1 mL 0.1 mol·L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 判断某卤代烃中的卤素 | 取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液 | 若产生的沉淀为白色,则该卤代烃中含有氯元素 |
| D | 探究蔗糖在酸性水溶液中的稳定性 | 取2mL20%的蔗糖溶液于试管中,加入适量稀 H2SO4后水浴加热5 min;再加入适量新制Cu(OH)2悬浊液并加热 | 若没有生成砖红色沉淀 ,则蔗糖在酸性水溶液中稳定 |
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
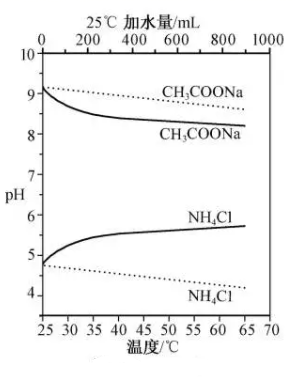
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
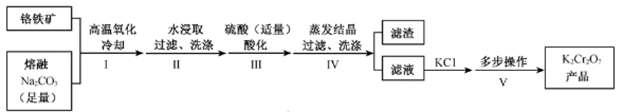
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
Cr2O
+H2O
相关物质的溶解度随温度变化如下图。
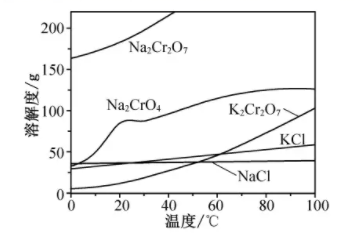
请回答:
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
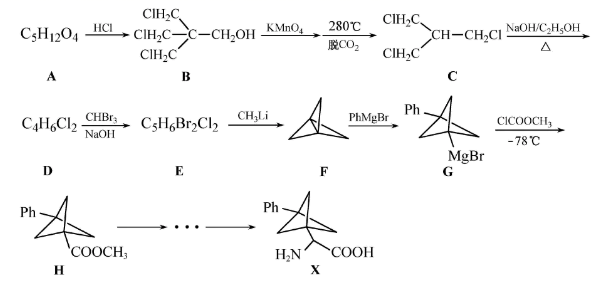
已知:R1—CH=CH—R2
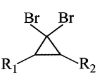
R3Br R3MgBr
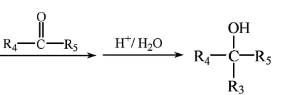
请回答:
①包含 ![]() ;
;
②包含 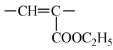 (双键两端的C不再连接H)片段;
(双键两端的C不再连接H)片段;
③除②中片段外只含有1个-CH2-
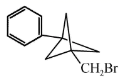 (也可表示为
(也可表示为 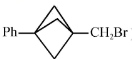 )
)