选项 | 实验操作及现象 | 结论 |
A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
D | 将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
a中反应 | b中检测试剂及现象 | |
A | 浓 | 淀粉 |
B |
| 品红溶液褪色 |
C | 浓 | 酚酞溶液变红 |
D |
| 溴水褪色 |
|
|
方案设计 |
现象和结论 |
|
A |
先加入少量KClO3溶液,再加 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
B |
加到少量 |
若溶液褪色,则样品为亚硝酸钠 |
|
C |
先加到少量 |
若溶液变黄色,则样品为亚硝酸钠 |
|
D |
先加入少量 |
若产生白色沉淀,则样品为亚硝酸钠 |
实验 | 结论 | |
A | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2﹣二溴乙烷无色、可溶于四氧化碳 |
B | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
C | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
D | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的一氯甲烷具有酸性 |
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向滴有酚酞的Na2CO3溶液中滴加CaCl2溶液 | 生成白色沉淀,红色褪去 | Na2CO3溶液中存在水解平衡 |
B | 向MgCl2溶液中先滴加过量NaOH溶液,再滴加CuCl2溶液 | 先生成白色沉淀,后生成蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
C | 向未知溶液中滴加盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 未知溶液中一定含有SO2 |
D | 用铂丝蘸取少量某溶液进行焰色试验 | 火焰呈黄色 | 该溶液一定为含钠元素的盐溶液 |
|
|
|
|
A.分离碘单质和 | B.蒸发 | C.制备氢氧化铁胶体 | D.乙醇脱水制乙烯 |

选项 | 实验操作 | 现象 | 解释或结论 |
A | 向FeBr2溶液中加入少量新制氯水,再加CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
B | 取丙烯醛(CH2=CHCHO)于试管中,滴加酸性KMnO4溶液 | 酸性高锰酸钾溶液褪色 | 说明丙烯醛中含有碳碳双键 |
C | 向20%蔗糖溶液中加入少量稀硫酸,加热,再加入银氨溶液 | 未出现银镜 | 蔗糖未水解 |
D | 将乙醇和浓硫酸混合,迅速加热到170 ℃ ,将产生的气体通入溴水中 | 溴水褪色 | 说明乙醇发生消去反应且产物是乙烯 |
目的 | 方案设计 | 现象和结论 | |
A | 检验未知溶液中是否含有铵盐 | 取一定量未知溶液 于试管,滴入NaOH溶液并加热,试管口放置湿润红色石蕊试纸 | 试纸变蓝,说明溶液中一定含有铵盐 |
B | 鉴别NaCl与NaNO2 | 各取少量固体加水溶解,分別滴加盐酸酸化的 FeCl2溶液,观察溶液颜色变化 | 溶液变黄色的是NaNO2 , 不变色的是NaCl |
C | 比较AgCl和AgI的 Ksp大小 | 向2.0mL0.1mol/LNaCl溶液中滴入2滴0.mol/LAgNO3溶液,振荡静置,再滴入4滴0.1mol/LKI溶液,观察现象 | 先出现白色沉淀, 后出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
D | 检验乙醇的消去反应是否有乙烯生成 | 将乙醇在浓硫酸、170℃条件下产生的气体依次通过足量NaOH溶液、酸性高锰酸钾溶液 | 观察到酸性高锰酸钾褪色,说明有乙烯生成 |

A | B | C | D |
|
|
|
|
配制0.10mol·L-1NaCl溶液 | 制备并收集NH3 | 制备Fe(OH)3胶体 | 检查装置气密性 |
选项 | 实验操作 | 实验现象 | 结论 |
A | 用pH试纸测溶液pH |
|
|
B | 向钾盐溶液中滴加浓盐酸 | 产生的无色气体使品红溶液褪色 | 该钾盐一定是 |
C | 分别取 |
|
|
D | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 不能确定溶液中含有Na元素 |

选项 | 探究方案 | 探究目的 |
A | 用pH计测量浓度均为0.1mol/L的醋酸和盐酸,比较两溶液pH大小 |
|
B | 向2mL 1mol/L NaOH溶液中滴加2滴0.1mol/L | |
C | 向盛有 |
|
D | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 | 氧化性: |
选项 | 实验操作 | 实验现象 | 结论或解释 |
A | 将Na2O2与SO2反应后的固体物质加水溶解后,先加足量的稀硝酸,再滴加BaCl2溶液 | 产生白色沉淀 | 说明Na2O2与SO2反应后生成了Na2SO4 |
B | 铜丝和浓硫酸加热一段时间后冷却,向反应后的溶液中加水稀释 | 溶液呈蓝色 | 说明反应生成了硫酸铜 |
C | 向无水乙醇中加入浓硫酸,加热至170℃,将产生的气体通入酸性KMnO4溶液中 | 紫红色褪去 | 乙醇发生消去反应生成乙烯 |
D | 向Na2S溶液中通入足量CO2 , 然后再将产生的气体导入CuSO4溶液中 | CuSO4溶液中产生黑色沉淀 | Kal(H2CO3)>Kal(H2S) |
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验现象或目的 | 分离I2和KMnO4固体 | 浓氨水与浓硫酸反应 | 制备Fe(OH)2 , 并观察其颜色 | 检验乙炔气体可使酸性高锰酸钾溶液褪色 |

已知:①H2O、卤化氢等杂质易使Ni催化剂中毒;②催化剂乙基蒽醌难溶于水,易溶于有机溶剂,熔点107-111℃。下列说法中正确的是
 a﹣模拟工业制纯碱
B .
a﹣模拟工业制纯碱
B .  b﹣制乙酸乙酯实验中接受产物
C .
b﹣制乙酸乙酯实验中接受产物
C .  c﹣除去氯气中的氯化氢
D .
c﹣除去氯气中的氯化氢
D .  d﹣实验室制乙炔
d﹣实验室制乙炔
编号 | 实验操作 | 实验现象 | 解释与结论 |
A | 铜与浓硝酸反应,生成气体用湿润KI﹣淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该沉淀可能是BaSO4 , 该溶液中可能含有SO42﹣ |
C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水退色 |
D | 在稀AgNO3溶液中先加入少量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
 检查装置气密性
B .
检查装置气密性
B .  除去甲烷中的乙烯
D .
除去甲烷中的乙烯
D .  分离甲苯与乙醇
分离甲苯与乙醇
 除去甲烷中乙烯
B .
除去甲烷中乙烯
B .  从碘的CCl4溶液中分离出碘
C .
从碘的CCl4溶液中分离出碘
C .  检查装置气密性
D .
检查装置气密性
D .  分离甲苯与乙醇
分离甲苯与乙醇

提出假设 稀释 溶液或改变
浓度,
电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的
和
溶液,按下表配制总体积相同的系列溶液;测定
,记录数据。
|
序号 |
|
|
|
|
|
|
Ⅰ |
40.00 |
/ |
/ |
0 |
2.86 |
|
Ⅱ |
4.00 |
/ |
36.00 |
0 |
3.36 |
|
… |
|||||
|
Ⅶ |
4.00 |
a |
b |
3∶4 |
4.53 |
|
Ⅷ |
4.00 |
4.00 |
32.00 |
1∶1 |
4.65 |
①根据表中信息,补充数据: ,
。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡(填”正”或”逆”)向移动;结合表中数据,给出判断理由:。
③由实验Ⅱ~VIII可知,增大 浓度,
电离平衡逆向移动。
实验结论 假设成立。
查阅资料获悉:一定条件下,按 配制的溶液中,
的值等于
的
。
对比数据发现,实验VIII中 与资料数据
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定
溶液的浓度再验证。
(ⅰ)移取 溶液,加入2滴酚酞溶液,用
溶液滴定至终点,消耗体积为
,则该
溶液的浓度为
。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述 溶液和
溶液,配制等物质的量的
与
![]() 混合溶液,测定pH,结果与资料数据相符。
混合溶液,测定pH,结果与资料数据相符。
|
Ⅰ |
移取 |
|
Ⅱ |
,测得溶液的pH为4.76 |
实验总结 得到的结果与资料数据相符,方案可行。
方案1
实验装置 | 加入液体试剂 | 反应现象 |
| 10mL 30% | 开始无明显现象,静置10小时后,溶液变为浅蓝色,铜片上有少量蓝色沉淀,之后不再有明显变化 |
i.还原反应
ii.氧化反应
i.增大 , 增强
的氧化性
ii.降低,增强Cu的还原性
编号 | 加入液体试剂 | 反应现象 |
方案2 | 10mL30% | 开始产生少量气泡,溶液变为蓝色,片刻后,反应越来越剧烈,甚至形成大量泡沫涌出(经检测,生成气体可使带火星木条复燃),反应后剩余铜片表面光亮 |
方案3 | 10mL 30% | 生成较多气泡,溶液变为深蓝色。一段时间后,反应逐渐变慢,此时铜片上覆盖少量蓝色沉淀物。 |
方案2与方案3均在一定程度上加快了反应。
①方案2中,生成气体明显更剧烈的原因是。
②方案3中发生主要反应的离子方程式为。
③试评价方案2在回收铜过程的优缺点。
编号 | 加入液体试剂 | 反应现象 |
方案4 | 10mL 30% 2mL 5mol/L氨水 同时加入少量固体 | 生成较多气泡,溶液变为深蓝色。反应后铜片变薄且表面光亮。 |
试分析的作用。
①用离子方程式表示上述反应原理。
②通常条件下,含的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因。
已知:FeCl3晶体易升华,FeCl3溶液易水解。

装置C中碱石灰的作用是。
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:和
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1:与过量的Cu粉反应生成
, 再结合
生成白色沉淀
。
猜想2:与
发生氧化还原反应生成
, 再结合
生成白色沉淀
。
针对上述猜想,实验小组同学设计了以下实验:
实验编号 | 操作 | 现象 |
实验1 |
| 加入铜粉后无现象 |
实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
实验结果说明猜想(填“1”或“2”)不合理。
i.与
可发生如下两种反应:
反应A:(淡黄色);
反应B:(黄色)。
ii.与
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A(填“>”或“<”)B,说明反应B(填“是”或“不是”)产生的主要原因。
②进一步查阅资料可知,当反应体系中同时存在、
、
时,
氧化性增强,可将
氧化为
。据此将实验2改进,向
溶液中同时加入
、
, 立即生成白色沉淀
, 写出该反应离子方程式。
已知:①碱式碳酸铜的组成与溶液pH有关;
②碱式碳酸铜和碳酸氢钠在水溶液中比固态时更易分解。
实验室制备四水甲酸铜的步骤如下:
I.称取12.5 g CuSO4·5H2O和9.5 g NaHCO3 , 充分研细并混合均匀。
II.将I中所得混合物加入到100 mL接近沸腾的蒸馏水中,加完混合物后继续加热至接近沸腾状态数分钟。
III.静置溶液澄清后,用倾析法分离得到沉淀,用蒸馏水洗涤,干燥。
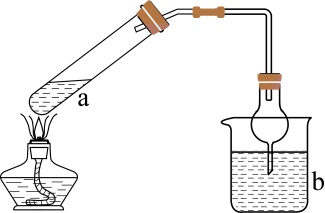
IV.将III中所得的产品放入如图装置中的三颈烧瓶,加入约20 mL蒸馏水,加热搅拌至50℃左右。

V.向三颈烧瓶中加入甲酸,反应结束后趁热过滤。
VI.经过一系列操作得到Cu (HCOO) 2·4H2O 7.91 g。
回答下列问题:
实际取用的硫酸铜和碳酸氢钠的物质的量之比小于1:2,这样操作的原因是。

回答下列问题: