选项 | 实验操作及现象 | 结论 |
A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
D | 将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |

Sn与Si同族,25℃时相关的溶度积见表。
化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+ , 且无气体生成,则生成的硝酸盐是,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2 , 焙烧时,与NaOH反应的化学方程式为。
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于mol•L-1。
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+ , 再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO被还原为I— , 终点时消耗KIO3溶液20.00mL。
①终点时的现象为,产生I2的离子反应方程式为。
②产品中Sn的质量分数为%。

①存贮时,Na应保存在中。
②冷凝水的进口是(填“a”或“b”)。
③用Na干燥甲苯的原理是(用化学方程式表示)。
④回流过程中,除水时打开的活塞是;体系变蓝后,改变开关状态收集甲苯。

①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加热12小时,反应物完全反应。其化学反应方程式为。用Ar气赶走空气的目的是。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是和。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为kPa,需NaN3的物质的量为mol(保留3位小数)。已知:p=a×n,其中a=2.5×105kPa•mol-1 , n为气体产物的物质的量。

温度/℃ | 700 | 800 | 830 | 1000 |
平衡常数 | 1.67 | 1.11 | 1.00 | 0.59 |
①反应的△H0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是。

①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是。
②某温度下,H2在Pd膜表面上的解离过程存在如下平衡: , 其正反应的活化能远小于逆反应的活化能。下列说法错误的是。
A.Pd膜对气体分子的透过具有选择性
B.过程2的△H>0
C.加快Pd膜内H原子迁移有利于H2的解离
D.H原子在Pd膜表面上结合为H2的过程为放热反应
③同温同压下,等物质的量的CO和H2O通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应器,CO的平衡转化率为90%,则相同时间内出口a和出口b中H2的质量比为。

①固体电解质采用(填“氧离子导体”或“质子导体”)。
②阴极的电极反应式为。
③同温同压下,相同时间内,若进口Ⅰ处n(CO):n(H2O)=a:b,出口Ⅰ处气体体积为进口Ⅰ处的y倍,则CO的转化率为(用a,b,y表示)。


①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
反应路线Ⅰ:
反应路线Ⅱ:
已知以下信息:
①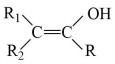
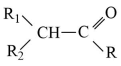
 (R、R1、R2为H或烃基)
(R、R1、R2为H或烃基)
②![]() +2ROH
+2ROH +H2O
+H2O