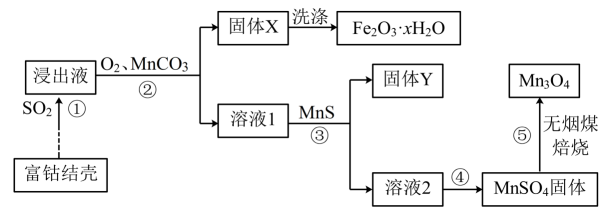
已知:①“浸出液”中主要含有的金属离子为:;
②温度高于时,
在水中的溶解度随温度升高迅速降低;
③“焙烧”的过程发生的部分反应有 ,
下列有关说法错误的是( )
实验装置 |
|
|
|
|
实验目的 | 演示喷泉实验 | 证明 | 配制100mL | 分离苯和苯酚的混合物 |
选项 | A | B | C | D |
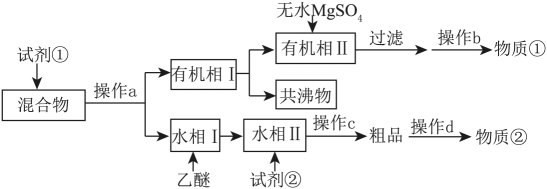
已知:苯甲酸乙酯的沸点为212.6℃,乙醚-环己烷-水共沸物的沸点为62.1℃,苯甲酸100℃会迅速升华

 B .
B .  C .
C .  D .
D . 
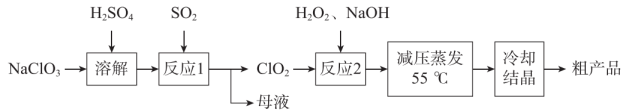
下列说法错误的是

已知:溶液在加热时易分解产生
和
;“溶解”工序发生的反应为可逆反应。下列说法错误的是

流程中几种物质的沸点如表
物质 | ||||
沸点 | 136 | 127 | 57 | 180 |
“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
一定温度下,
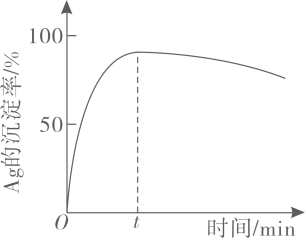
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。
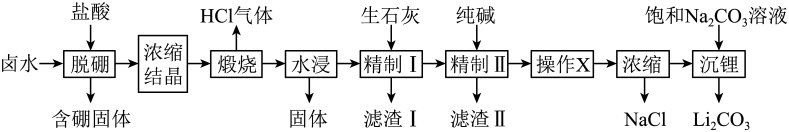
已知:常温下,。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:

已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:

查阅资料
ⅰ.为紫色;
ⅱ.对苯酚与
的显色反应无影响;
ⅲ.对特定波长光的吸收程度(用吸光度A表示)与
的浓度在一定范围内成正比。
提出猜想:
猜想1:对苯酚与
的显色反应有影响
猜想2:对苯酚与
的显色反应有影响。
猜想3:对苯酚与
的显色反应有影响。
进行实验:
常温下,用盐酸调节pH配制得到pH分别为a和b的溶液(
),用硫酸调节pH配制得到pH分别为a和b的
溶液。取
苯酚溶液于试管中,按实验1~4分别再加入
含
的试剂,显色
后用紫外-可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对
水解程度的影响可忽略)。
| 序号 | 含 | 吸光度 | |
|
| |||
1 | / | |||
2 | / | |||
3 | / | |||
4 | / | |||
结果讨论 实验结果为。
①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:溶液、
溶液、
固体、
固体)
| 序号 | 含 | 再加入的试剂 | 吸光度 | |
|
| ||||
5 | / |
| |||
6 | / | ||||
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且对苯酚与
的显色反应起抑制作用,得出此结论的依据是。
④根据实验1~6的结果,小组同学得出猜想3成立,且对
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是。
已知:ⅰ.
ⅱ.
①加入溶液前需加热除去多余的
, 否则会使测定结果(填“偏高”或“偏低”)。
②若消耗标准溶液的体积为
, 则样品中苯酚的浓度为
(用含
、
、
的代数式表示)。

已知:①辉铜矿主要含有Cu2S及少量SiO2、 Fe2O3等杂质,软锰矿主要含有MnO2及少量SiO2、Fe2O3等杂质。
②S在CS2中的溶解度随温度升高而增大;CS2的沸点为46.2 ℃。
③[ Cu(NH3)4]2+(aq)Cu2+ (aq) + 4NH3(aq)
请回答下列问题:
②研究表明矿物中溶解生成的Fe3+可作催化剂,促进Cu2S与MnO2的溶解,其过程有三个反应,反应方程式分别为:(i) Fe2O3+ 3H2SO4=Fe2(SO4)3+3H2O;(ii) Cu2S+ 2Fe2(SO4)3=2CuSO4+4FeSO4+S;写出(iii)的化学反应方程式。


A.第1次读数时,仰视
B.停止加热后,体系未恢复到室温即读数
C.第2次读数时,E管液面高于D管,未调液面即读数

已知:①单宁酸是一种只含C、H、O元素的有机化合物
② , 常温下
,
,
,
③当溶液中某离子的物质的量浓度不大于时,该离子沉淀完全

已知:
①软锰矿的成分如下:
|
成分 |
MnO2 |
Fe2O3 |
CaO |
SiO2 |
其他不反应杂质 |
|
质量分数 |
69.6% |
7.6% |
5.6% |
9.0% |
8.2% |
②K2MnO4在强碱性溶液(pH大于13.5)中稳定,在酸性、中性和弱碱性环境中会发生歧化反应生成和MnO2。
③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。
①若反应时,N元素的化合价不变,则锰酸锂与稀硝酸和双氧水反应的离子方程式为。
②样品中锰酸锂的纯度为%(保留两位有效数字)。

回答下列问题
①参照表格,简要说明除钙的操作方法。
②60℃下CaSO4的Ksp=。(饱和CaSO4溶液的密度约为1.0g∙L−1)
部分物质的溶解度(g/100gH2O)如表:
温度/℃ 物质 | 20 | 40 | 60 | 80 |
MgSO4 | 28.6 | 30.9 | 36 | 40.8 |
CaSO4 | 0.272 | 0.23 | 0.204 | 0.184 |

已知:
①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中×100%]越大,絮凝效果越好。
回答下列问题:
①x和y的关系应满足:y=(用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是。

②加热ZnSO4·7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4·7H2O(M=287g/mol)加热到145℃时得到ZnSO4·xH2O,其中x的值为;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为。

①某种HR的结构简式为 ,该分子中可能与
,该分子中可能与形成配位键的,原子有。
②解释反萃取时的作用:。
反应终点pH | 沉淀率/% | |
1.5 | 94.04 | 0.19 |
2.5 | 99.21 | 0.56 |
3.8 | 99.91 | 3.31 |
①生成黄钠铁矾的离子方程式是。
②沉淀时最适宜选用的反应终点pH是。
a.6~7 b.9~10 c.11~12
①为使、
除尽,必须保持溶液中
。
②若调节溶液的pH偏低、将会导致、
沉淀不完全,其原因是。 [
,
,
]。

①该工艺中设计萃取、反萃取的目的是。
②萃取率随pH升高先增大后减小的可能原因是。

①B点剩余固体产物为(写出计算过程)。
②钴的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有个。


①实验中球形干燥管的作用是。
②磷酸的分布分数x(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。生成的离子方程式为。

③向滤液中先通入后加入
溶液的原因是。
②实验中须用到的试剂:2
溶液、0.1
NaOH溶液。浸渣中含NiO、少量的
和不溶性杂质。请完成从浸渣制备
的实验方案:。

已知:① ,
;②溶液中某离子浓度
时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表
离子 | |||||
开始沉淀的pH | 7.5 | 2.7 | 8.1 | 7.7 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 9.4 | 8.4 | 9.8 |
回答下列问题:



回答下列问题:
①用离子方程式表示“滤液a”呈酸性的原因。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、、洗涤、干燥,得NH4Cl固体。

实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
实验II.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是,实验II中H2O2的作用是。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是。

室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:

已知:①NH4VO3难溶于水,(VO2)2SO4易溶于水;
② +2H+
+ H2O;
③几种金属离子以氢氧化物沉淀时的pH如下表。
金属氢氧化物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 4.0 | 4.6 |
完全沉淀的pH | 3.7 | 5.2 | 6.0 |
请回答下列问题:
序号 | 起始读数 | 终点读数 |
① | 0.10 | 20.55 |
② | 0. 02 | 20.12 |
③ | 0.03 | 19. 93 |
该产品的纯度为%。若滴定过程中,振荡时间太长,则测得的结果 (填“偏高”“偏 低”或“无影响”)。(已知:2Na2S2O3 +I2 =Na2S4O6 + 2NaI)