
回答下列问题:
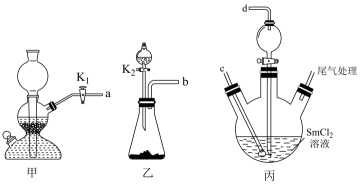
装置的连接顺序是a→,←b(填接口字母);
准确称取产品试样,溶于
稀盐酸中,加入
缓冲溶液,加入
紫脲酸铵混合指示剂,用
标准溶液滴定至呈蓝紫色(
),消耗
溶液
。
产品中碳酸钐的质量分数。
将装置A称重,记为。将提纯后的样品装入装置A中,再次将装置A称重,记为
, 将装有试剂的装置C称重,记为
。按下图连接好装置进行实验。

①打开、
和
, 缓缓通入
;
②数分钟后关闭 , 打开 , 点燃酒精喷灯,加热A中样品;
③一段时间后,熄灭酒精灯,打开 , 通入
数分钟后,冷却到室温,关闭
和
, 称量装置A.重复上述操作步骤,直至装置A恒重,记为
(此时装置A中为
)。称重装置C,记为
。
实验步骤②中关闭,打开(填写止水夹代号)。
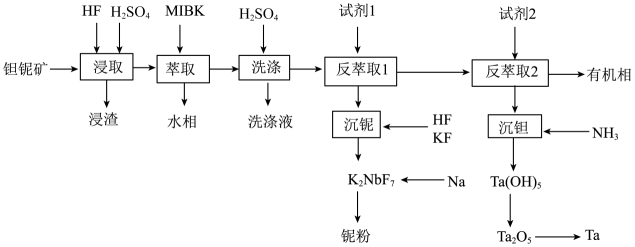
“浸取”后,浸出液中含有两种二元强酸和锰、钛等元素。
已知:①为甲基异丁基酮;②

①流程中钠热还原法制备铌粉的化学方程式为。
②传统的熔盐电解法采用的电解质体系通常为 , 电解总化学反应方程式为。
Ⅰ.
Ⅱ.
回答下列问题:
①当转化率达到60%时,反应达到平衡状态,这时
和
的平均相对分子质量为23,若反应Ⅱ的
, 平衡时反应速率
;
②经验公式为
, 其中
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
(用含
、
、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是。

由图可知,温度相同时选择性的实验值略高于其平衡值,可能的原因是。
a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:

已知时,
, 平衡体系总压强为P,则
反应c的平衡常数
。