



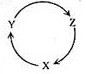
| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
NaHCO3+H2 HCOONa+H2O下列有关说法正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色 | 而该废铁屑中不含Fe(III) |
B | 向Na2SO3溶液中先加入少量Ba(NO3)2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀中加入稀盐酸,沉淀不溶解 | Na2SO3溶液已经变质 |
C | 向CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀生成 | Cu2+可以氧化I- , 白色沉淀可能为CuI |
D | 向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解 | Ag2O是两性氧化物 |

已知:①“沉铂”时发生的反应为[ PtCl6]2- +2 = (NH4)2PtCl6↓。
②隔绝空气“煅烧”时有两种单质生成,其中一种是 N2。
下列说法正确的是( )


请回答:
组成X的四种元素是N、H和(填元素符号),X的化学式是。
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“ ”相同。

将浓硫酸和浓盐酸混合可产生 气体的原因是。

已知:i.0.1mol·L-1金属离子形成氢氧化物沉淀与氢氧化物沉淀溶解的pH范围如下:
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Mg2+ | |||
开始沉淀的pH | 1.5 | 4.0 | 4.6 | 7.6 | 9.5 | |||
沉淀完全的pH | 2.8 | 5.2 | 6.8 | 9.7 | 11.1 | |||
金属氢氧化物 | Al(OH)3 | Cr(OH)3 | ||||||
开始溶解的pH | 7.8 | 12 | ||||||
溶解完全的pH | 10.8 | >14 | ||||||
ii.Cr(OH)3+OH-=+2H2O
iii.已知Cr的金属性强于Fe
①通过制得有机磷萃取剂
, 其中
代表烃基,
对
产率的影响如下表。
| 82 | 62 | 20 |
由表可知,随着碳原子数增加,烃基(填“推电子”或“吸电子”)能力增强,键更难断裂,
产率降低。


①试剂X为(填“”或“
”),应调节
为。
②通入得到
沉淀的过程为:
i.
ii.(写出该过程的化学方程式)
③若萃取剂改用三丁基氧化膦会导致“反萃取”
产率降低,其原因为。
i.
ii.……
写出ii的离子方程式:。

为减少的生成,“浸锰”的适宜温度是,向过滤II所得的滤液中加入
溶液时温度不宜太高的原因是。
I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:
;
II.加入过量KI溶液和适量稀 , 沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L
溶液进行滴定,发生反应:
, 滴定终点时消耗
溶液20.00mL。
①写出II中反应的离子方程式;
②判断滴定终点的方法是;
③假设杂质不参与反应,则产品纯度为。(保留四位有效数字)

已知:钪与铝类似,其氢氧化物具有两性;是钪元素的萃取剂,萃取发生的反应为
。

已知:i.Ksp(CaF2)=1.0×10-10 , Ksp(MgF2)=7.5×10-11;
ii.NiSO4在水中的溶解度随温度升高明显增大,不溶于乙醇和苯。
回答下列问题:
a.冷水 b.乙醇 c.苯
I.制备


①
②
③
写出基态的价电子排布式。

已知:
①当溶液中被沉淀离子的物质的量浓度小于1 × 10-5mol/L时,认为该离子沉淀完全。
②Ksp(NiS)=1 × 10-21 , 氢硫酸的两步电离常数分别为Ka1=1.4× 10-7 , Ka2=7.1×10-15。

回答下列问题:
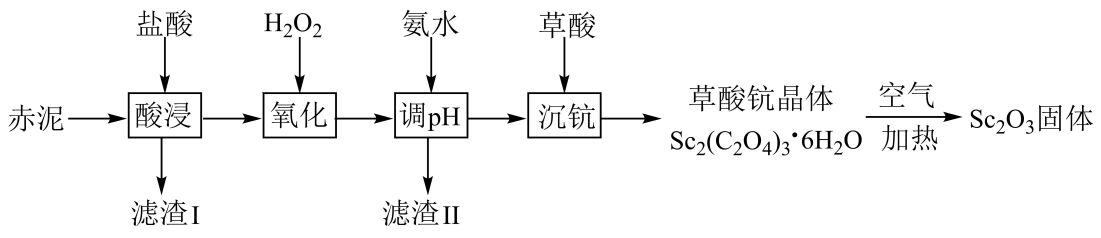
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
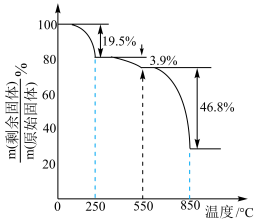
250℃时固体的主要成分是(填化学式);550~850℃时反应的化学方程式为。
a. b.
c.

已知: ,
,
反应I
反应Ⅱ
已知常压下的沸点为136.4℃,C的燃烧热为
, CO的燃烧热为
。
①反应I的。
②从反应I的混合体系中分离出的措施是。
③氯化炉中生成CO比生成更有利于
转化为
, 其原因是。

“酸洗”时,转化为
或
“水解”后得到
。
①写出“热碱浸取”时发生反应的离子方程式:。
②锐钛型和金红石型是最常见的两种晶体类型,煅烧
过程中,
会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得
制备金红石型
的操作方案:,金红石型
的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子。

③为测定回收所得样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL
溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000
溶液(过量),再用0.01000
标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平):
;
计算样品的纯度(写出计算过程)。

已知:①钛酸钠难溶于水;
②溶液的酸性较强时,价钒主要以
的形式存在;
③溶液中某离子浓度 , 认为该离子沉淀完全。
回答下列问题:



回答下列问题:



已知:①电弧炉是由石墨电极和石墨坩埚组成的高温加热装置;
②高温下蒸气压大、易挥发;
③可溶于热的浓硫酸形成
。
回答下列问题:


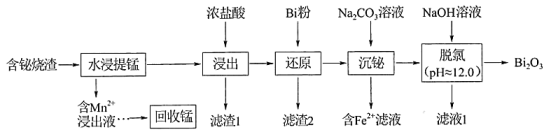
已知:①氧化性:;
②易水解成BiOCl沉淀;常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,;
。
回答下列问题:
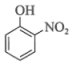 )的熔点,其原因是。
)的熔点,其原因是。
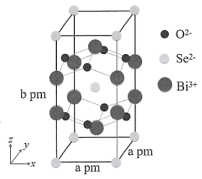
①该晶胞沿z轴方向的投影图为(填标号)。
A.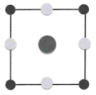 B.
B. C.
C. D.
D.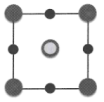
②该晶体中,每个周围紧邻的
共有个。
③该晶体的密度为(列出计算式,
为阿伏加德罗常数的值)。
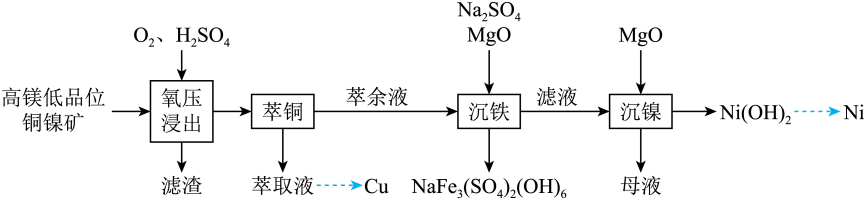
回答下列问题: