 B . 定容
B . 定容  D . 蒸馏
D . 蒸馏 
| 选项 | A | B | C | D |
| 装置或操作 | | | | |
| 预期目的 | 检验乙醇催化氧化产物中有乙醛 | 用于实验室里制备氨气 | 蒸干FeCl3溶液制备无水FeCl3 | 探究氧化性:KMnO4>Cl2>I2 |
 C . 做SO2与NaOH溶液的喷泉实验
C . 做SO2与NaOH溶液的喷泉实验  D . 用NaOH标准溶液滴定锥形瓶中的盐酸
D . 用NaOH标准溶液滴定锥形瓶中的盐酸 






a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液
①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4 沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72- 充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3 溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为。平行滴定3次,消耗Na2S2O3 溶液的平均用量为18.00mL。则该废水中Ba2+ 的物质的量浓度为mol/L,
②在滴定过程中,下列实验操作会造成实验结果偏高的是(填字母)。
a.滴定管未用Na2S2O3溶液润洗
b.滴定终点时俯视读数
c.锥形瓶用蒸馏水洗涤后未进行干燥处理
d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡

|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=(保留小数点后一位).
②上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母).
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计

|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积 |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=。
|
熔点/℃ |
沸点/℃ |
密度/g/mL |
化学性质 |
|
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P+3Cl2 (少量) 2P+5Cl2 (过量) |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇氧气生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。

回答下列问题:
通入仪器甲中的冷却水从(填“M”或 “N”)口出来;仪器乙为下端浸在冷水中的仪器,乙的名称为。
测定产品中PCl3纯度的方法如下:迅速称取4.400g产品,水解完全后配成500mL溶液,取出25.00mL加入过量0.1000mol/L20.00mL碘溶液,充分反应后再用0.1000mol/LNa2S2O3溶液滴定过量的碘,终点时消耗12.00mLNa2S2O3溶液。已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6 , 假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为 [已知:M(PCl3)=137.5g/mol];若滴定终点时仰视读数,则PCl3的质量分数(填“偏大”、“偏小”或“无影响”)。
请你设计一个实验方案,证明H3PO3为二元酸:。

查阅资料:
| 物理性质 | 物理性质 | |
| 金属锂(Li) | 熔点180C,沸点1340C | 与氨气反应: 2Li+2NH3=2LiNH2+H2↑ |
| 氮化锂 (Li3N) | 红色晶状固体,能吸附H2 | ①易水解:Li3N+3H2O=3LiOH+NH3↑ ②高温时能腐蚀镍、铜、石英等 |
回答下列问题:


已知:
a.KIO3是一种白色晶体,加热至560℃开始分解,不溶于乙醇。
b.KIO3在水中溶解度数据如下:
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 4.7 | 6.2 | 8.1 | 12.2 | 18 | 25 | 32 |
c.滤液a中不含锰元素。
请回答:
①滴定终点的现象是。
②若滴定结束时仰视读数,则测定的结果(填 “偏大”、“偏小”或“无影响”)。


①实验室也可用 B 装置制备NO,X装置的优点为。
②检验装置气密性并装入药品,打开 K2 , 然后再打开 K3 , 通入一段时间气体,其目的是 ,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
①设计实验证明 HNO2 是弱酸:。(仅提供的试剂:1 mol•L-1 盐酸、 1 mol•L-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是亚硝酰氯(ClNO)的质量分数为 。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(Ag2CrO4)=1×10-12)
A. 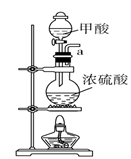 B.
B. 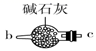 C.
C.  D.
D. 
请说出图B中盛装碱石灰的仪器名称。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是;实验时,不需加热也能产生CO,其原因是。
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。

打开k2 , F装置中发生反应的化学方程式为;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是,H装置的作用是。

步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3 , 反应的离子方程式为。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。

①仪器a的名称是 ;转化温度为35 ℃, 采用的合适加热方式是。
②步骤②中H2O2的作用是 (用化学方程式表示)。

①若滴定管未用 EDT A 标准液润洗,测定结果将 (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 (保留四位有效数字)。
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗

b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化

已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
|
开始沉淀时的pH |
3.7 |
2.3 |
7.6 |
5.4 |
|
完全沉淀时的pH |
5.2 |
3.2 |
9.7 |
6.7 |
回答以下问题:

请回答:
组成X的三种元素是,X的化学式为。

步骤1:关闭K2、K3 , 打开K1 , 制备NaClO。
步骤2:操作A,制备N2H4·H2O。
NH3与NaClO反应生成N2H4·H2O的化学方程式为。