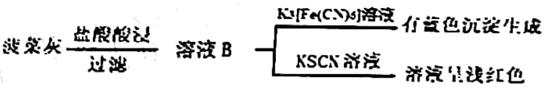
Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的 形式存在)进行检测。实验如下:
a.水煮检验法:

b.灼烧检验法:

已知:几种物质的溶解度( )如下:
| | | | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
趁热过滤的原因是:。

回答下列问题:
②在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是。
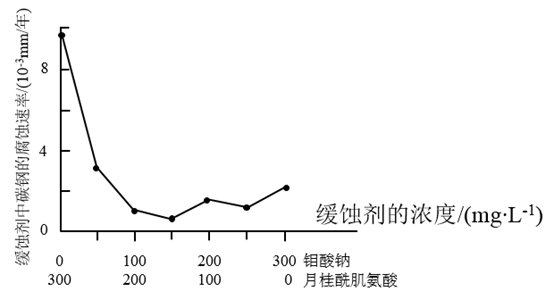
要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为。
②过程1生成 的反应热为
;过程2产生
的反应热为
。则制取C的反应
的
为。

合成的粗尿素中含有 杂质。通过控制温度和压强,可将
分解为
和
。研究温度和压强对
分解率的影响,结果如下:

若X代表压强,则温度:
(填“>”或“<”)。

写出尿素被降解的电极反应式:。

该反应过程中从 到
压强变小原因是。