I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
|
CO2(mol) |
H2(mol) |
CH3OH(mol) |
H2O(mol) |
|
|
反应a(恒温恒容) |
1 |
3 |
0 |
0 |
|
反应b(绝热恒容) |
0 |
0 |
1 |
1 |
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2 , 分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
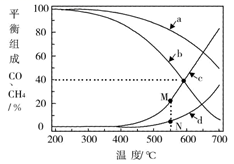
1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是和。M点平衡组成含量高于N点的原因是。
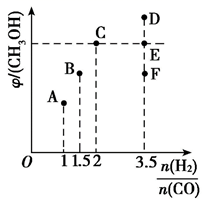
当 时,达到平衡后,CH3OH的体积分数可能是图像中的(填“D”、“E”或“F”)点。
步骤1:如图所示装置的三颈烧瓶中,加入132.3g氯乙酸(ClCH2COOH)、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9至10之间。

步骤2:蒸出部分水至液面有薄膜,加少量热水,操作1。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,操作2 , 分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,操作3、过滤、干燥,得羟基乙酸钠。
请回答下列问题:
I.工业上用精炼铜的阳极泥(硒主要以CuSe形式存在,还含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体。
已知:①H2Se(g)+1/2O2(g)⇌Se(s)+H2O(l) ΔH1=mKJ•mol−1
②2H2(g)+O2(g)=2H2O(g) ΔH2=nKJ•mol−1
③H2O(g)=H2O(l) ΔH3=pKJ•mol−1
反应H2(g)+Se(s)⇌H2Se(g)的反应热ΔH=kJ•mol−1(用含m、n、p的代数式表示)。
②某含钴配合物化学式为CoCl3·3NH3 , 该配合物在热NaOH溶液中发生反应产生絮状沉淀,并释放出气体,该反应的化学方程式为。该配合物中存在的化学键有(填字母)。
A.共价键 B.σ键 C.π键 D.配位键
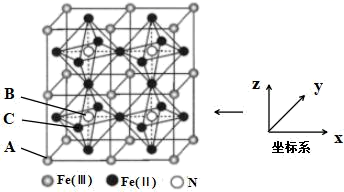
①该结构中单纯分析铁的堆积,其堆积方式为。
②已知A点的原子坐标参数为(0,0,0),B点的原子坐标参数为( ),则C点的原子坐标参数为。

已知: 
请回答下列问题:

 。这种衍生物满足以下条件的所有同分异构体有种,其中苯环上含有两个甲基的结构简式为。
。这种衍生物满足以下条件的所有同分异构体有种,其中苯环上含有两个甲基的结构简式为。 a.属于芳香族化合物,但不能和FeCl3溶液发生显色反应
b.1mol该有机物能与2molNaOH恰好完全反应
c.核磁共振氢谱峰面积之比为1:6:2:3