| 选项 | 实验操作 | 现象 | 结论 |
| A | 用结净干燥的玻璃棒蘸取浓硫酸点在干燥的pH试纸上 | 试纸变黑 | 体现浓硫酸的吸水性 |
| B | 将乙醇和浓硫酸混合溶液加热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 有乙烯生成 |
| C | 某无色溶液滴加盐酸,产生无色气体通入澄清石灰水中 | 石灰水先变浑浊后变澄清 | 无色溶液中一定含有CO |
| D | 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/L ZnSO4溶液,再滴2滴0.1mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | Ksp(ZnS)与Ksp(CuS)大小无法判定 |
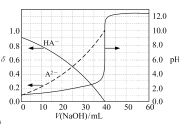
已知:A2−的分布系数为
|
熔点/℃ |
沸点/℃ |
密度/g/mL |
化学性质 |
|
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P+3Cl2 (少量) 2P+5Cl2 (过量) |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇氧气生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。

回答下列问题:
通入仪器甲中的冷却水从(填“M”或 “N”)口出来;仪器乙为下端浸在冷水中的仪器,乙的名称为。
测定产品中PCl3纯度的方法如下:迅速称取4.400g产品,水解完全后配成500mL溶液,取出25.00mL加入过量0.1000mol/L20.00mL碘溶液,充分反应后再用0.1000mol/LNa2S2O3溶液滴定过量的碘,终点时消耗12.00mLNa2S2O3溶液。已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6 , 假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为 [已知:M(PCl3)=137.5g/mol];若滴定终点时仰视读数,则PCl3的质量分数(填“偏大”、“偏小”或“无影响”)。
请你设计一个实验方案,证明H3PO3为二元酸:。


已知:a.纯ClO2熔点为-59℃,沸点为11℃ ,纯的ClO2受热或遇光易发生爆炸,一般稀释到10%以下。
b.长期放置或高于60℃时,NaClO2易分解生成NaClO3和NaCl。
a.常温、密封、不避光 b.低温、密封、避光 c.常温、敞口、避光 d.低温、敞口、不避光
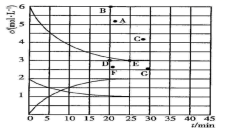
①该温度下,若向同容积的另一容器中投入N2、H2、NH3 , 其浓度均为2mol/L,则此时v正v逆(填“大于”或“小于”或“等于”)。
②在此温度下,若起始向一个固定容积为1L的密闭容器中充入4molN2和12molH2 , 则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为。
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.58 | 0.50 | 0.50 |
已知该反应V正(NO2)=K1·c2(NO2),V逆(N2O4)= K2·c(N2O4)其中k1、k2为速率常数,则373K时, =。
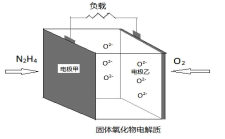
![]()
0.1mol 3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是。
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是 (填序号,下同),违背洪特规则的是。
A. ![]() B.
B. ![]() C.
C. ![]()

①该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为g•cm﹣3(用含有r、NA的最简代数式表示)。

已知:① 
②RCN ![]() RCOOH
RCOOH
③RCOOH RCOCl
RCOOR’
①氰基(-CN)接在苯环 ②能与金属钠反应