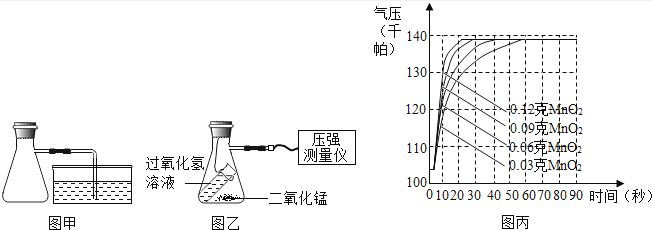
小明在学习了“用过氧化氢制取氧气”的知识后,进行如下实验:
①按图中甲组装实验仪器并进行气密性检查。
②取10毫升溶质质量分数为3%的过氧化氢溶液0.03克二氧化锰装入容器,塞紧橡皮塞,接上压强测量仪(如图乙)。
③倾斜装置,使过氧化氢溶液和二氧化锰充分混合,用压强测量仪测量容器内的气压。
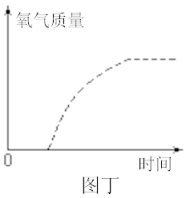
④分别用0.06克、0.09克和0.12克相同的二氧化锰重复上述实验,整理相关数据如图丙。
许多科学发现从重视微小差异开始。科学家瑞利和拉姆塞正是重视氮气密度的微小差异,才最终发现了稀有气体氩气。
材料一:1892年瑞利发现,在相同条件下,由空气中除去氧气、二氧化碳、水蒸气和灰尘后获得的氮气,其密度为1.2572克/升;由含氮化合物反应并除去水蒸气后获得的氮气(NH4NO2==N2↑+2H2O),其密度为1.2505克/升,两者密度差值虽小;却完全超出了实验误差范围。
材料二:1894年4月瑞利和拉姆塞开始用如图装置进行“清除空气中氮气”的实验研究:在倒立圆底烧瓶内引入两根金属导线,通电使瓶中空气里的氧气和氮气生成氮的氧化物,用碱液来吸收生成的氮的氧化物和原有的二氧化碳气体。并从气体进口不断向瓶内补克氧气,使反应持续进行。

材料三:瑞利和拉姆塞又设计了另一实验装置,将上述实验所得的气体干燥后,通过红热的铜粉来除去其中的氧气,得到少量的剩余气体,对剩余气体做光谱分析得知,这是一种未知的气体,并测得其密度约是氮气的1.5倍。1894年8月13日他们共同宣布:发现了一种未知气体,并命名为氩气。
材料四:1898年拉姆塞等人利用不同的物质沸点不同,又发现了氪气、氖气、氙气。
根据上述材料,回答下列问题:
①取5只250毫升集气瓶,向5只集气瓶中分别装入25毫升、50毫升、75毫升、100毫升、125毫升的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5。
②用分解过氧化氢(H2O2)的方法制取氧气,通过排水法将上述1~5号瓶中的水排去。
③将带火星的木条依次插入1~5号瓶中,把观察到的现象和计算数据,填入下表。
集气瓶标号 | 1 | 2 | 3 | 4 | 5 |
集气瓶中氧气的体积分数 | 28.9% | 36.8% | 44.7% | 52.6% | 60.5% |
带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
试回答下列问题:
实验内容 | 实验现象 | 实验结论 |
氧气浓度越大,燃烧越剧烈 |
资料显示,将新制的溶质质量分数为5%的H2O2溶液,加热到80℃时,才有较多氧气产生,而相同质量5%的H2O2溶液加入催化剂,常温下就会立即产生氧气,反应速度快,所需时间短.
为验证空气中氧气的体积分数,小明按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数总是远小于21%,他认为误差主要由实验装置造成,于是改用图乙装置进行实验,步骤如下:
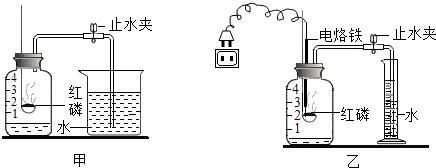
①连接装置并检查气密性.
②在量筒内加入100毫升的水.
③在广口瓶中加入少量水,使瓶内空气体积为250毫升.
④在燃烧匙内放入过量的红磷,塞紧瓶塞,关闭止水夹,接通电源使电烙铁发热,点燃红磷后,断开电源.
⑤燃烧结束并充分冷却后,打开止水夹,待量筒内水面不再下降时,记录量筒内水的体积为65毫升.
小明发现,测量结果与真实值仍有较大差距,查阅资料发现,引起本实验的误差除装置外,还与可燃物的性质有关.
实验 | 1 | 2 | 3 |
步骤 | 将一片铝箔在空气中用酒精灯加热 | 将另一片相同铝箔伸入到充满氧气的集气瓶中,引燃 | 将一段镁条在空气中用酒精灯加热 |
现象 | 铝箔不燃烧,溶化后也不滴下,外面立即形成一层薄膜 | 铝箔剧烈人少,发出耀眼白光 | 镁条剧烈燃烧,发出耀眼白光 |
试回答下列问题:
在学习了实验室制取氧气的知识后.某科学小组同学对于“含氧化合物制氧气“问题。提出了如下观点:
【观点】Ⅰ.只有含氧化合物才能作为反应物制氧气;
Ⅱ.任意一种含氧化合物都可以作为反应物制氧气。
【已知】实验室制氧气的反应原理如下:
①2H2O2 2H2O+O2↑ ②2KClO3
2H2O+O2↑ ②2KClO3 2KCl+3O2↑ ③2KMnO4
2KCl+3O2↑ ③2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
对于以上观点,该小组同学决定用学过的科学知识和科学方法加以证明.请你一同参与探究并完成下列问题:
①他们判定观点Ⅰ正确的理论依据是 。
②除上述实验室制氧气的三种反应物以外,请你再列举﹣种能分解生成氧气的非金属氧化物 。(填化学式)
上述对照实验的方案是: 。(要求写出操作方法、实验现象及结论)
①选择适当仪器,组装成如图1所示的实验装置;

②检查装置气密性,装置气密性良好;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④将药品平铺于干燥试管底部,在导管口放置蓬松的棉花团,塞上橡皮塞,固定于铁架台上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,用毛玻璃片将集气瓶口盖好,从水中取出并正放在桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出
请回答下列问题:

蜡烛(主要含C、H、O无素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
①燃烧的产物可能有CO2。
②燃烧的产物可能有H2O。
除了上述猜想,你的猜想:燃烧的产物可能有。
实验一:在密闭容器中点燃蜡烛至熄灭,抽取10毫升密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊。从实验的科学性考虑,下一步是(选填字母)。
A.直接得到燃烧产物中没有CO2的结论
B.再多抽取一些气体注入到试管中的石灰水中
C.增加饱和澄清石灰水的质量
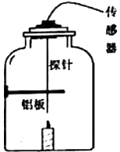
实验二:在老师的指导下,利用多功能传感器进行有关量的测量,装置如图所示。实验结束后,铝板表面有黑色固体颗粒,同时传感器采得实验前后的有关数据如表所示:
相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
蜡烛点燃前 | 48.4% | 18.7% | 0.058% | 0 |
蜡烛熄灭后 | 71.6% | 15.6% | 3.643% | 0.0182% |
由实验及结果分析,密闭容器内蜡烛熄灭的原因是;蜡烛燃烧生成的产物是。
请你分析以下实验装置,并学习所提供的材料.
实验装置:

学习材料:氨气(NH3)是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水.氨气能使湿润的红色石蕊试纸变蓝色.实验室可用加热氯化铵和熟石灰两种固体的方法制取氨气[2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O].
铵盐易溶于水.Ca(OH)2微溶于水.氯化银(AgCl)是白色固体,难溶于水.CaCl2溶于显中性,NH4Cl溶液显酸性.
请回答:
某同学对制取氨气反应后反应器内的固体物质进行了进一步的研究:
①取反应器内少量固体于试管中,加水溶解、过滤,得到滤液.
②取少量滤液于试管中,向试管中滴加无色酚酞溶液,溶液颜色无变化,说明固体物质中不含Ca(OH)2 .
③另取少量滤液于试管中,向试管中滴加AgNO3溶液,产生白色沉淀,该同学得出了固体物质中一定含有NH4Cl的结论.
你认为“固体物质中一定含有NH4Cl”的结论是否正确 (填“是”或“否”),理由是 .