①过量的Fe在Cl2中燃烧;②Fe和过量盐酸反应;③向FeCl2溶液中通入少量Cl2;④将Fe和Fe2O3的混合物溶于盐酸中
选项 | 知识描述 | 化学知识或原理 |
A | 熬胆矾铁釜,久之亦化为铜 | 胆矾是混合物 |
B | 丹砂(HgS)烧之成水银,积变又还成丹砂 | 过程发生分解反应和化合反应 |
C | “火树银花不夜天”指的是金属元素的焰色试验 | 焰色试验属于化学变化 |
D | 故宫红墙的涂料常用铁红作红色颜料 | 铁红的主要成分为 |

①钠与水反应生成NaOH和;所有金属与水反应都生成碱和
②铁制品露置在空气中一段时间后就会生锈;铝的性质比铁活泼,铝制品在空气中不能稳定存在
③Al与S直接化合时可得到;Fe与S直接化合时也可得到
④受热易分解,Al(OH)3、Cu(OH)2受热也易分解

。

①从化合价角度看,具有氧化性,可能与填字母)发生反应。从物质类别角度看,
属于盐,可能与填字母)发生复分解反应
A、 B、Fe C、NaOH D、
E、
②向溶液中滴加KSCN溶液(含K+和SCN-),会生成血红色溶液,该反应可用来检验
溶液中的
, 反应方程式为FeCl3+3KSCN=Fe(SCN)3+3KCl。向该血红色溶液中继续滴加NaOH溶液,则会生成红褐色沉淀,写出该反应的离子方程式
①由在上图的位置(未画出)可预测:
具有填“氧化性”或“还原性”)
②工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为: , 请用双线桥分析上面的化学方程式。
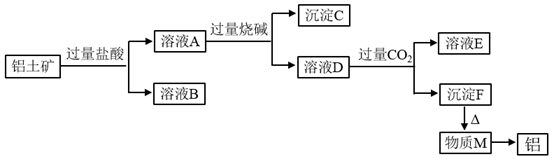
请回答下列问题:

①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入溶液,(填现象)。
③取少量B于试管中,加入(填试剂),液体变为红色。
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有、
、和。
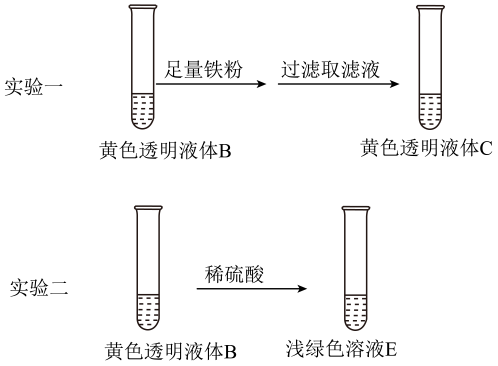
①实验一中,加入铁粉的作用是(用离子方程式表示)。
②由上述实验得出:B显黄色的主要原因不是因为含有 , 而是因为含有。理由是: 。
①取25.00mL A,加入足量稀硫酸,可与24.00mL溶液恰好完全反应。已知
在酸性环境下被还原为
, A中
的浓度为
, 说明其主要成分仍然是
。
②下列实验可以使用A进行的是(填字母)。
a.向A中滴入NaOH溶液,制备纯净的沉淀
b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对溶液的配制与使用有了更深入的理解。
①写出实验2试管中发生反应的离子方程式:。
②请用离子方程式解释产生红棕色气体的原因:。
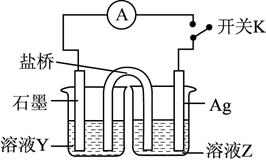
①溶液Y为。
②为实现该实验目的,接下来的操作及现象为。
,取实验2试管中充分反应静置后的上层清液
,用
标准溶液滴定,至终点时消耗
标准溶液。
①判断滴定终点现象为;
②实验2试管中反应的平衡常数 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因: 。
资料2:部分植物吸收铁元素的系统主要通过3个蛋白酶系统进行:①H+-ATPase蛋白酶系统通过分泌大量的氢离子而使土壤酸化,使难溶性的Fe(OH)3溶解释放Fe3+。②由Fe3+螯合还原酶 (FRO)和NADPH脱氢酶组成Fe3+还原系统,释放的Fe3+与植物体内的螯合剂形成螯合物后自由进出细胞质体,由还原系统将Fe3+螯合物转换释放成Fe2+螯合物。③Fe2+转运蛋白 (IRT)系统能将Fe2+螯合物跨膜运输到根部,再由其他转运蛋白输送到各个细胞供机体利用。
土壤中是否存在Fe3+
土壤中是否存在Fe2+。
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
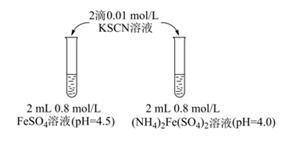
溶液的稳定性:FeSO4(NH4)2Fe(SO4)2(填“>”或“<”) 。
操作:取,加,观察。
现象:与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。
分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O⇌4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是,原因是。
资料:①FeCO3是白色固体。
②H2CO3需要达到一定浓度才能以CO2形式逸出。
根据实验现象,说明不同时施用的原因是。