
微生物驱动的硫氧化过程:硫氧化过程是指将低价态的单质硫或还原性硫化物完全氧化为硫酸盐或部分氧化成更高价态的硫化物。
S2O32-+O2+= S4O62-+
人类向大气中排放SO2 , 会影响到红树林中的硫循环过程。
沉积物有机硫中有一种含硫有机物:![]() , 和碳原子相比,硫原子吸引电子能力更(填“强”或“弱”),写出一个证明非金属强弱的方程式:。
, 和碳原子相比,硫原子吸引电子能力更(填“强”或“弱”),写出一个证明非金属强弱的方程式:。
国家速滑馆“冰丝带”是北京冬奥会最具科技含量的场馆,它采用了当前冬季运动场馆最环保的制冰技术之一为二氧化碳跨临界直接制冰技术。


已知:(NH4)2CO3(aq)+CO2(aq)+H2O(l) 2NH4HCO3(aq) ΔH=-25.3 kJ·mol-1
吸收CO2时宜选用 (选填“低温”或“高温”)理由 、(列举两点)。
弱电解质 | H2CO3 | NH3·H2O |
电离平衡 常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
试结合电离平衡常数,判断并解释0.1 mol·L-1NH4HCO3溶液的酸碱性。
北京举办的两届奥运会火炬“飞扬”和“祥云”分别使用氢气和丙烷作为燃料
2022冬奥会“飞扬”:①2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
2008奥运会“祥云”:②C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ·mol-1
常压下,单位质量燃料完全燃烧放出热量叫做该燃料的热值。热值:H2C3H8(填写“大于”、“小于”或“等于”)

资料2:部分植物吸收铁元素的系统主要通过3个蛋白酶系统进行:①H+-ATPase蛋白酶系统通过分泌大量的氢离子而使土壤酸化,使难溶性的Fe(OH)3溶解释放Fe3+。②由Fe3+螯合还原酶 (FRO)和NADPH脱氢酶组成Fe3+还原系统,释放的Fe3+与植物体内的螯合剂形成螯合物后自由进出细胞质体,由还原系统将Fe3+螯合物转换释放成Fe2+螯合物。③Fe2+转运蛋白 (IRT)系统能将Fe2+螯合物跨膜运输到根部,再由其他转运蛋白输送到各个细胞供机体利用。
土壤中是否存在Fe3+
土壤中是否存在Fe2+。
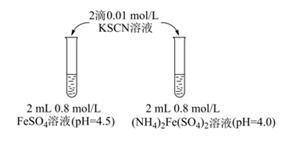
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
溶液的稳定性:FeSO4(NH4)2Fe(SO4)2(填“>”或“<”) 。
操作:取,加,观察。
现象:与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。
分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O⇌4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是,原因是。
资料:①FeCO3是白色固体。
②H2CO3需要达到一定浓度才能以CO2形式逸出。
根据实验现象,说明不同时施用的原因是。

环己醇与氯代环己烷均不能发生________。(单选)

已知:
①
②![]()
B中官能团名称为。
①1molX能与足量银氨溶液生成4molAg
②X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

写出以环己醇( )和乙醇为原料合成
)和乙醇为原料合成 的路线流程图。
的路线流程图。
方法1:皮江法:
反应①:CaCO3·MgCO3= CaO·MgO+2CO2
反应②:2CaO·MgO(s)+Si(s) 2CaO·SiO2 (l)+2Mg(g)
方法2:电解法
阳极反应;阴极反应。
平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将(填“升高”“降低”或“不变”)。

已知:①用EDTA滴定法测定金属离子的浓度的定量关系:n(金属离子)=n(EDTA);
②碳酸盐的溶度积常数:Ksp(CaCO3)=3.8×10-9、Ksp(MgCO3)=1.1×10-5。
沉钙前,需用EDTA滴定法测定粗制卤水中金属离子的浓度,结果如下表:
| 滴定序号 | 卤水样品用量/mL | 0.025mol/LEDTA用量/mL | |
| 滴定Ca2+、Mg2+ | 滴定Ca2+ | ||
| ① | 25.00 | 28.06 | 12.06 |
| ② | 25.00 | 28.70 | 12.53 |
| ③ | 25.00 | 28.74 | 12.91 |
滴定过程所需玻璃仪器有。