|
A |
B |
C |
D |
|
|
|
|
|
|
制备 |
分离乙醇和乙酸 |
验证 |
测量 |
 B .
B .  C .
C .  D .
D . 
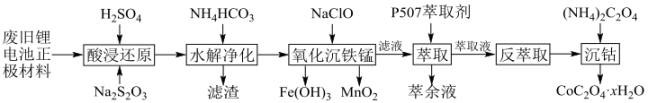
已知该工艺条件下,有关金属离子沉淀完全的pH见下表:
离子 | ||||||
pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
回答下列问题:

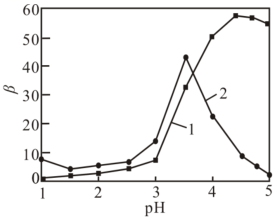
图1 水相pH对萃取率的影响 图2 水相pH对分离因素的影响
由图可知,萃取时的最佳水相pH为____(填字母)。