

 B .
B .  C .
C . 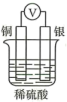 D .
D . 



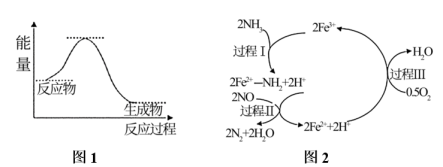
已知:N2(g)+3H2(g)2NH3(g) ΔH=—92kJ/mol。下列关于合成氨反应的叙述中错误的是( )
下列说法错误的是( )





①电池的负极是。(填“电极a”或“电极b”)
②H+通过质子交换膜时的移动方向是。
a.从左向右 b.从右向左
③通入O2的电极反应式是。
实验 | 现象 | |
|
| Ⅰ中:Fe表面产生大量无色气泡,液面上方变为红棕色 Ⅱ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;Cu表面始终产生红棕色气泡 |
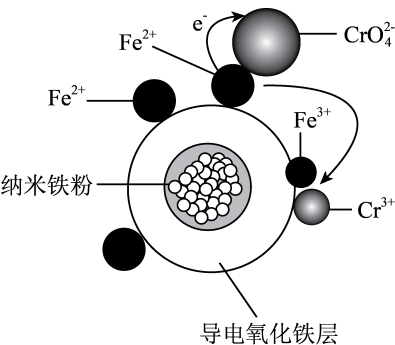
①取少量Ⅰ中溶液,加入KSCN溶液,(填现象),说明产生了Fe3+;Ⅰ中Fe表面产生大量无色气泡的化学方程式为。
②Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明浓硝酸具有性。
①甲池为(填“原电池”或“电解池”);B电极上发生的现象为。
②乙池中的银电极上的电极反应式为。
③丙池中E电极为(填“正极”、“负极”、“阴极”或“阳极”);闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是(填化学式);丙池中的离子膜为(填“阳离子交换膜”或“阴离子交换膜”)
①A电极的反应方程式为。
②若线路中转移0.02mol电子,乙池中D极质量变化g。
③二氧化氯(ClO2)为黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出也能用丙池装置制取二氧化氯。写出生成二氧化氯的电极反应式为。
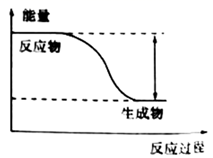
①该反应为(填“吸热”或“放热”)反应。
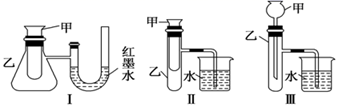
②如图三个装置中,不能证明“铁与稀硫酸反应是吸热反应还是放热反应”的是。
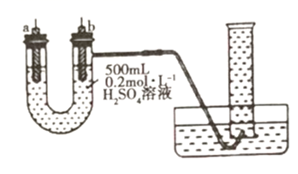
①若a、b极不用导线相连,则b极材料为(填“纯铁片”或“纯铜片”)。当收集到 (已折算为标准状况,且溶液体积不变)气体时,用时
,则用
表示的平均反应速率为
。
②将a、b极(a极为“纯铁片”,b极为“纯铜片”)用导线相连,则电子在导线上的流动方向为从到(填“a极”或“b极”,下同);此时a极的电极反应式为,当收集到 (已折算为标准状况)气体时,用时
。
③根据上述实验所得结论为。