 C . 电解过程中有
C . 电解过程中有





实验装置 | 实验现象 | |
| I.a为AgCl | II.a为AgI |
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明 | 两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色 | |
下列说法错误的是
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:
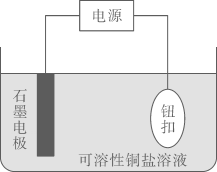
装置示意图 | 序号 | 电解质溶液 | 实验现象 |
| ① | 0.1mol/L | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 |
② | 0.1mol/L | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
实验①中,无色气体产生的原因是或。

已知:电解效率η的定义为η(B)=×100%
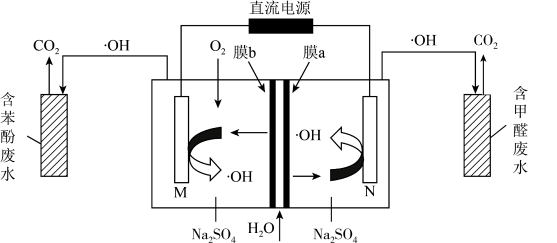
①电极b是极。
②生成的电极反应式是。
③向阳极室和阴极室各加入100mL溶液。制备的同时,还在电极b表面收集到2.5×10-4mol气体,气体是。经测定η(
)为80%,不考虑其他副反应,则制备的(NH4)2S2O8的物质的量浓度为mol/L。
已知:·具有强氧化性,Fe2+浓度较高时会导致
·猝灭。
可将苯酚氧化为CO2 , 但反应速率较慢。加入Fe2+可加快反应,过程为:
ⅰ. +Fe2+=
+
·+Fe3+
ⅱ. ·将苯酚氧化
① ·氧化苯酚的离子方程式是。
②将电解得到的含溶液稀释后加入苯酚处理器,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图。

用等物质的量的铁粉代替FeSO4 , 可明显提高苯酚的降解率,主要原因是。
已知:电解中转移1mol电子所消耗的电量为F库仑
取处理后的水样100mL,酸化后加入KBr溶液,通电。电解产生的Br2全部与苯酚反应,当苯酚完全反应时,消耗的电量为a库仑,则样品中苯酚的含量为g/L。(苯酚的摩尔质量:94g/mol)