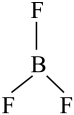
 (平面三角形)
D .
(平面三角形)
D . 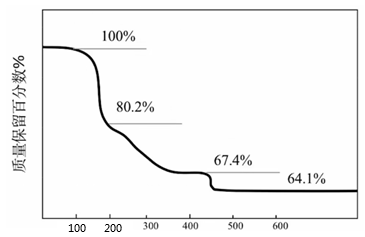
 (平面三角形)
D . 基态
(平面三角形)
D . 基态 B . 醛基的电子式:
B . 醛基的电子式: C . 质子数为78,中子数为124的铂(Pt)的原子符号:
C . 质子数为78,中子数为124的铂(Pt)的原子符号:
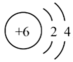 , 可以表示
, 可以表示 的实验式:C5H9
的实验式:C5H9
 D . HCl的电子式:
D . HCl的电子式: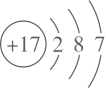 B . HCl的电子式:
B . HCl的电子式: 
①A电极是(填“阴极”或“阳极”),其电极反应式是。
②U4+有较强的还原性。用质子交换膜隔开两极区溶液可以,从而提高U4+的产率。
|
UF4 |
UF6 |
|
|
熔点/℃ |
1036 |
64(150kPa) |
|
沸点/℃ |
1417 |
56.5升华 |
①离心富集 时,采用UF6的优点:
a.F只有一种核素 ,且能与U形成稳定的氟化物;
b.。
② 和
的相对分子质量之比约为(列出计算表达式)。

①该配合物中中心原子的化合价为;与中心原子形成配位键的原子是。
②与ClO4-互为等电子体的一种非极性分子是(举1例)。
③1 mol Bipy中所含σ键mol。
①26Al和27Al (选填编号)。
A.是同一种元素 B.是同一种核素
C.具有相同的中子数 D.具有相同的化学性质
②碳元素的一种核素也可以考古断代,其原子符号为 。
③10g10Be所含的中子数与质子数之差为 个。
②A、C 元素简单气态氢化物的稳定性:>(用分子式表示),原因是。
③AC2的电子式为。