
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
① | 1.47 | 2.15 | |
② | 2.38 | 1.67 | |
③ | a | b | |

图11L0.1mol•L-1NH4HCO3溶液中加入一定量NaOH后各粒子浓度变化曲线

图21L0.1mol•L-1NH4HSO3溶液中加入一定量NaOH后各粒子浓度变化曲线



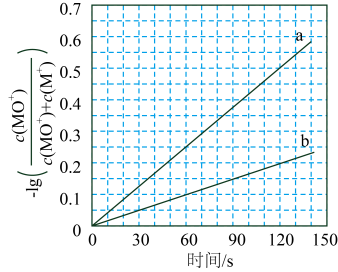
研究发现上述反应中 其中
为常数。下列说法正确的是( )

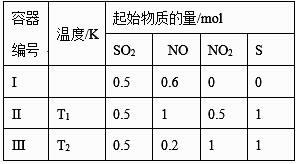
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
①
②
③
计算反应④的
;
⑤
⑥
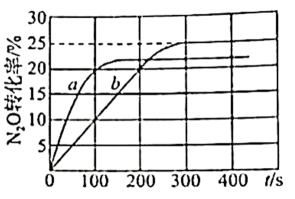
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是,理由是;

苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,X表示卤素)生成自由基
, 实现苯乙烯可控聚合。

a.升高温度 b.增大压强 c.加入催化剂

根据上述实验结果,可知,
。
则的
。
①
②
反应③的
, 平衡常数
(用
表示)。

(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与
反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与
反应,氘代甲醇的产量
(填“>”“<”或“=”)。若
与
反应,生成的氘代甲醇有种。
![]()
已知
,
关系如下图。

①“焙烧”过程最大的是。
A. B.
C.
②“焙烧”温度应控制在。
①若该反应的速率方程表示为:和
[
和
分别为正、逆反应速率常数,在一定温度下为常数],该反应的平衡常数
(用
、
表示)。
②焙烧时在入口持续通入空气,并不断用真空抽气泵在装置尾端抽气的目的是。
Ⅰ.
Ⅱ.
Ⅲ.
上述反应在体积为1L的密闭容器中进行,达到平衡时各气体体积分数和反应温度的关系曲线如图甲所示。

①下列说法正确的是。
A.1530 K之前乙炔产率随温度升高而增大的原因:升温使反应Ⅱ、Ⅲ平衡正向移动
B.1530 K之后会有更多的甲烷与乙烯裂解生成碳导致乙炔产率增加不大
C.1530 K时测得气体的总物质的量为1.000 mol,则反应III的平衡常数为0.8652
D.相同条件下,改用更高效的催化剂,可使单位时间内的乙炔产率增大
②请在图乙中绘制平衡时乙烯的体积分数和反应温度的变化趋势,并标明1530 K时的气体体积分数。


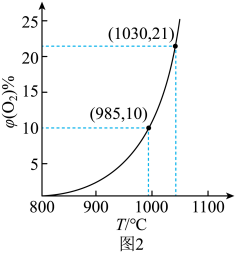
985℃时,的平衡转化率=(保留两位小数)。

由图3分析:使用(填“氧化铝”或“膨润土”) 掺杂的载氧体反应较快。
往盛有载氧体的刚性密闭容器中充入空气[氧气的物质的量分数
为21%],发生反应①。平衡时
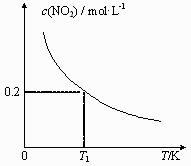
随反应温度T变化曲线如图2所示。
载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的载氧体,反应②的反应历程如图3。

基态核外电子排布式为,实验中所需的玻璃仪器有容量瓶、量筒和。(从下图中选择,写出名称)

资料卡片 ⅰ. ⅱ. |
将溶液与
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
①甲同学通过测定滤液中浓度测得K。取
滤液,用
标准溶液滴定滤液中
, 至滴定终点时消耗
标准溶液
。滴定终点的现象为,反应
的平衡常数
。(用含
、
、V的计算式表示)
②乙同学通过测定滤液中浓度测得K。取
滤液,加入
磺基水杨酸溶液,加入
为9~11.5的缓冲溶液,测定吸光度。测得溶液中
浓度为
, 则
的平衡常数
。(用含c的计算式表示)
用溶液和
溶液,按下表配制总体积相同的系列溶液,测定平衡时
浓度,记录数据。
序号 | ||||
Ⅰ | 10 | 10 | ||
Ⅱ | 2 | a | b |
a=,b=。和
存在的关系是(用含
和
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
则合成二甲醚反应的
。
I.
①恒容绝热容器中,一定能说明反应Ⅰ已达到化学平衡状态的是。
A.
B.
C.气体的密度保持不变
D.容器内气体的温度保持不变
②合成甲醇时存在逆水汽变换:II. , 按照
投料,保持压强为
下达到平衡时,
和
在含碳产物中物质的量百分数及
的转化率随温度的变化如图所示,图中(填“a”或“b”)表示甲醇在含碳产物中物质的量分数,
的转化率在
之后随温度升高而增大的原因是。若甲醇的选择性
, 图中
时甲醇的选择性=。逆水汽变换反应的压强平衡常数
。

实验测得: ,
,
、
为速率常数。
温度下,向
恒容密闭容器中加入
, 达到平衡时测得
的体积分数为60%,则平衡时
的产率
;当温度改变为
时,
, 则
(填“<”“>”或“=”)。

已知:①硒的沸点685℃,在空气中加热时会被氧化。
②在该工艺条件下,有关金属离子开始沉淀和恰好沉淀完全的pH如下表:
|
金属离子 |
|
|
|
开始沉淀的pH |
4.0 |
8.1 |
|
恰好沉淀完全的pH |
6.7 |
10.1 |
回答下列问题:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
已知:①敞口容器可看成恒压装置,体系压强在反应过程中与大气压(110*Pa)相等;
②反应中产生的物质的量相对于空气中很少,故可忽略不计,空气中
的体积分数约为0.04%;
③气体和液体共存于同一体系,如在溶剂E中发生的反应 , 其平衡常数表达式可表示为
(p为气体分压,
为液相体系中物质的物质的量分数,
)。
回答下列问题:


其中纵坐标表示GLD平衡产率的是图(填“甲”或“乙”);W最大的是(填“”“
”或“
”)。图丙为在不同催化剂下反应相同时间。DMC的转化率随温度变化的关系,图丙上的(填字母)点可能是甲、乙两图像所测绘时选取的位置。
Ⅰ.
Ⅱ.
kJ·moL⁻¹
Ⅲ.
kJ·moL⁻¹
已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性
丙烯收率
回答下列问题:
a.  b.
b.  c.
c.  d.
d. 

①温度高于600℃时丙烯的选择性降低幅度增大的原因是。
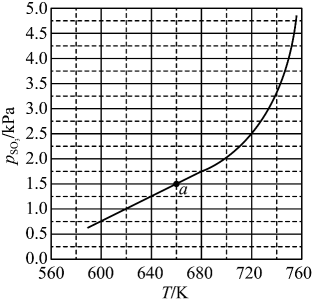
②580℃,min时,反应体系达到平衡,丙烷的平衡转化率为,
kPa·min⁻¹。反应Ⅰ的压强平衡常数
kPa(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。

已知:气体分压(p分)=气体总压(p总)×体积分数。
请回答:
判断该反应的自发性并说明理由。

可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
①;②+5I -+ 6H+ = 3I2+3H2O;③。
已知:
则;若将两等份
和
分别充入恒压密闭容器中,在无催化剂和有催化的情况进行反应,相同时间下测得
的转化率与温度的关系如图所示,M点时
转化率相等的主要原因是。


①表示的体积分数随温度变化的曲线是 (填数字序号)。
②A、B、C三点对应的化学平衡常数、
、
从大到小的顺序为。
③205℃时,反应达到平衡后,的平衡转化率为 (结果保留一位小数),若平衡时总压为P,平衡常数
(列出计算式。以分压表示,分压=总压×物质的量分数)。

总反应: CO(g) + N2O(g) CO2(g) + N2(g) ∆H= kJ·mol-1; 该总反应的决速步是反应 (填 “①"或“②”),该判断的理由是.
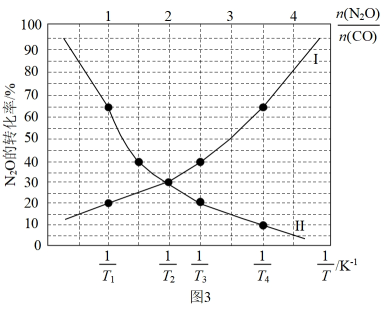
①表示N2O的转化率随的变化曲线为曲线(填“I”或“II”);
②T1T2 (填“>”或“<"),该判断的理由是
③已知:该反应的标准平衡常数 , 其中
为标准压强 (100kPa),p(CO2)、p(N2)、 p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数
= ( 计算结果保留两位有效数字,p分=p总 ×物质的量分数)。
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是。

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图。


①温度比较:气流a气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:。
③下列说法正确的是。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
①已知:CO2(g)和H2O(g)的生成焓为- 394 kJ/mol 和- 242 kJ/mol, 则△H =kJ/ mol,(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)。
②若要此反应自发进行, ( 填“高温”或“低温” )更有利。

某实验室模拟该反应,在2L恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1℃,反应开始时压强为800kPa,平衡时容器内气体总压强增加30%,则用平衡分压代替其平衡浓度表示化学平衡常数Kp=kPa [已知:气体分压(p分) =气体总压(p总)×体积分数]。

②上述反应分两步进行:
第一步(写化学方程式)△H> 0
第二步Cu/Zn* + 2H2 + CO2 = Cu/ZnO* + CH3OH △H< 0
③第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为。
a.  b.
b. 
c.  d.
d. 
主反应CO2(g) +3H2(g) CH3OH(g)+H2O(g) △H<0
副反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H>0
一定条件下,在装有催化剂的密闭容器中投入amolCO2和3amolH2 , 发生上述合成反应。
①在相同时间内,测得甲醇产率与温度的关系如图所示。温度为470K时,图中P点(填“处于”或“不处于”)平衡状态;490K之后,甲醇的产率随温度的升高而减小的原因可能是。

②某温度下,达平衡时容器中CH3OH的物质的量为c mol, CO的物质的量为d mol。则此条件下CO2的转化率为(列式表示,下同);甲醇的选择性(指转化为甲醇的CO2占发生反应的CO2的百分比)为;此条件下副反应的平衡常数为。

Ⅰ.主反应:
Ⅱ.副反应:
Ⅳ.
则
