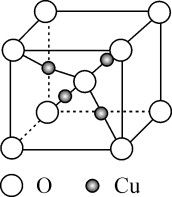
下列说法正确的是( )
物质 | NaCl | |||||||
熔点 | 920 | 801 | 1291 | 190 | 2073 | 1723 |

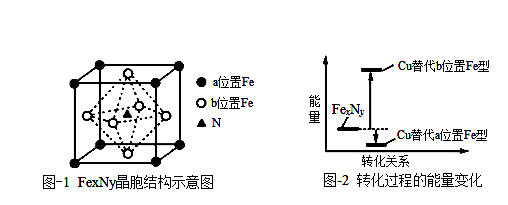
步骤1:先将该气体通入品红溶液中,观察现象;
步骤2:将步骤1中的气体通入酸性高锰酸钾溶液后再通过品红溶液,观察现象;
步骤3:再将步骤2中的气体通入澄清石灰水中,观察现象。
下列说法错误的是( )
 , 该合金化学式是FeC
, 该合金化学式是FeC

原子晶体 | 离子晶体 | 分子晶体 | |
A | 二氧化硅 | 硫酸 | He |
B | 碳酸氢铵 | ||
C | 金刚石 | 烧碱 | 白磷 |
D | 铜 | KOH | 碘晶体 |
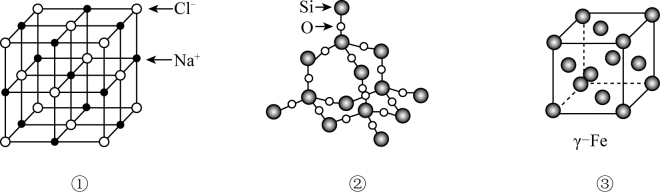


回答下列问题:
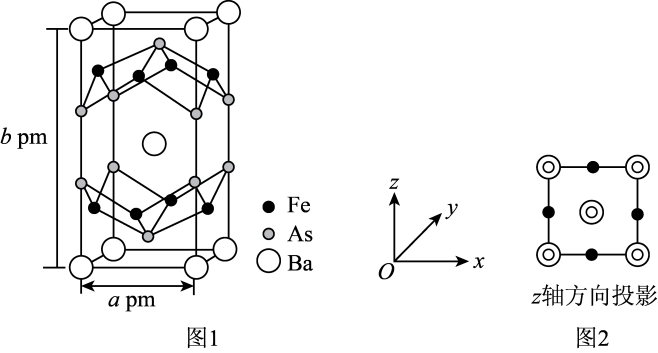
该晶体的化学式为,设NA表示阿伏加德罗常数的值,该晶体的密度是(用含a、b、NA的代数式表示)。


在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图乙所示。处于顶角位置的是原子。设Cr和Al原子半径分别为rCr和rAl , 则金属原子空间占有率为%(列出计算表达式)。