a.将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
b.根据计算结果,称量NaCl固体。
c.计算需要NaCl固体的质量。
d.将烧杯中的溶液沿玻璃棒注入100 mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将配制好的溶液倒入试剂瓶中,并贴好标签。
f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
维生素C,又称抗坏血酸,化学式为C6H8O6 , 是一种水溶性的有机化合物。
维生素C具有酸性,在酸性环境中稳定,遇氧气、热、光、碱性物质,特别是有氧化酶及痕量Cu2+、Fe3+等金属离子存在时,可促进其被氧化而破坏。人类不能自身合成维生素C,必须通过食物、药物等摄取,其广泛的食物来源为各类新鲜蔬果。
维生素C具有重要的生理功能,人体缺乏维生素C易引发坏血病、牙龈出血等。维生素C是一种常见的抗氧化剂,能够防止自由基对人体的伤害,从而增强人体抵抗力、延缓衰老等。此外维生素C还可以使Fe元素从+3价转化为+2价,提高肝脏对铁的利用率,从而治疗缺铁性贫血。若短期内服用过量的维生素C,会产生多尿、皮疹等副作用,长期服用过量的维生素C,可能导致草酸及尿酸结石。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。

实验 | 实验操作 | 丁达尔效应 |
1 | 向40 mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30 %) | 迅速出现 |
2 | 向40 mL蒸馏水中滴入5滴10 %FeCl3溶液,然后滴入1滴10 %NaOH溶液,边滴边搅拌 | 迅速出现 |
3 | 加热40 mL饱和FeCl3溶液 | 一段时间后出现 |
①实验1,生成Fe(OH)3胶体和(填化学式)。
②实验2与实验1对比,优点是(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH− 的物质可以是H2O或,控制反应条件即可制得。
资料:Ⅰ.pH>10时,Fe(OH)3胶体溶解。
Ⅱ.固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
实验4 取5 mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为粘稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体。
①根据资料,推测漏斗内棕褐色的烟中主要含有(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,。研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为 3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是。

④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是。
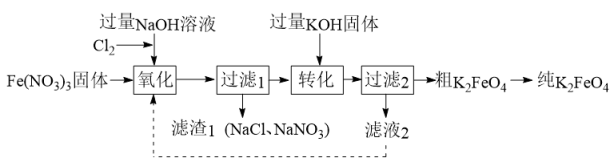
资料:Ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇。KOH易溶于乙醇。
Ⅱ.FeO在碱性溶液中稳定,中性和酸性溶液中不稳定。
ClO− + Fe3+ + _= FeO_+ _ + _
a.“氧化”中NaOH溶液过量的目的是使FeO稳定存在
b.“转化”中生成K2FeO4固体
c.设计物质循环的目的是提高原料的利用率
①计算K2FeO4的纯度=(列算式)。()
②若将稀硫酸换成稀盐酸,生成的气体中含有Cl2 , 导致K2FeO4的纯度的计算值偏大,原因是。