





例如:冠醚Z可与KMnO4发生如图所示的变化:

下列说法正确的是
含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
A. B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。

①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
,
),则B原子的坐标为。

A.[Ar]3d54s1 B.[Ar]3d5 C.[Ar]3d44s14p1 D.[Ar]3d54p1


①第三周期中基态原子的第一电离能比P大的元素有种。
②下列说法错误的是(填字母)。
A.黑磷分子中所用化学键的键能不完全相同|B.黑磷与石墨都属于混合型晶体
C.黑磷中P原子的杂化方式为sp3 D.黑磷分子中存在大π键,易导电

①Li+迁移过程发生(填“物理”或“化学”)变化。
②相同条件下,使用(填“LiPF6”或“LiAsF6”)作电极材料时,Li+迁移速率较快,原因是。

①写出PCl5熔融时的电离方程式。
②若晶胞参数为anm,则晶体的密度为g•cm-3(列出计算式)。
向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:。

①CuS晶体中,相邻的两个铜离子间的距离为pm。
②Cu2S晶体的密度为ρ=g·cm-3(列出计算式即可)。

①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
,
),则原子2和3的坐标分别为、。
CuaSnbSc属于三元化合物,是一种重要的半导体和非线性光学材料,具有杰出的热学、光学和机械等性质,因而备受人们的广泛关注。回答下列问题:


坐标 原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。

钴及其化合物有着广泛的应用前景。回答下列问题:

①配合物中提供孤对电子的原子是(填元素符号);
②该多齿配体中所含元素电负性由大到小的顺序为(填元素符号):
③下列化合物与上述配合物中C和N原子的杂化类型均相同的是(填标号)。

① 中存在的化学键类型有(填标号);
A.金属键 B.离子键 C.极性共价键 D.配位键
②与亚硝酸根互为等电子体的化合物有(写一种)。


2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料
Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发
射的设计和应用提供一个新的有效策略。
a. 键 b.σ键 c.配位键 d.极性键


①g-C3N4中氮原子的杂化类型是。
②根据图2,在图1中用平行四边形画出一个最小重复单元。
③已知该晶胞的体积为Vcm3 , 中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA , 则g-C3N4的密度为g.cm-3。

|
物质 |
BN |
AlN |
GaN |
|
熔点/℃ |
3000 |
2200 |
1700 |
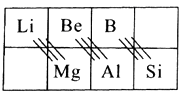
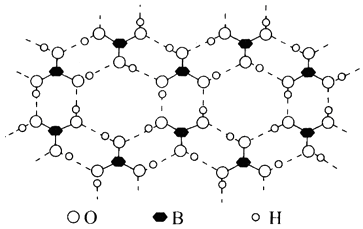
根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有mol氢键,H3BO3中B原子的杂化类型为。
铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。

氧元素在元素周期表中位于第周期族,硫原子核外有种能量不同的电子。

请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目
![]()
NaHSO3与 Cr2O72-反应时,物质的量之比为。