| 实验操作 | 实验现象 | |
| A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
| B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
| C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
| D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
实验1 | 实验2 | 实验3 |
|
|
|
镁条表面有微小气泡,且溶液较长时间无明显变化 | 镁条表面有较多气泡且产生气泡速率逐渐加快,溶液中无明显现象 | 镁条表面有大量气泡,溶液逐渐变为浑浊 |


资料:ⅰ.镁和水反应会在镁条表面形成致密的膜,阻碍反应进一步发生。
ⅱ.某些体积较小的离子能够“钻入”膜,达到使其溶解的效果,称作“离子钻入效应”。
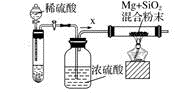
进行实验:常温下,向试剂X中加入长的光亮镁条。
|
实验序号 |
试剂X |
实验现象 |
|
Ⅰ |
|
镁条表面有微小气泡附着 |
|
Ⅱ |
|
迅速有大量无色气泡冒出,同时产生大量白色沉淀 |
|
Ⅲ |
|
镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡冒出 |
|
Ⅳ |
|
迅速有大量无色气泡冒出,滤液中逐渐出现白色浑浊 |
|
实验序号 |
试剂X |
实验现象 |
|
Ⅴ |
|
细微气泡冒出 |
|
Ⅵ |
|
镁条表面有微小气泡附着 |
①甲同学认为实验Ⅳ的滤液中含有 , 请设计实验方案证实其想法。
②对比实验Ⅳ和Ⅴ,可知对反应速率有影响。实验Ⅴ中的试剂X是。

①若粗盐中含有杂质离子、
、
, 精制时所用试剂为:A.盐酸;B.
溶液;C.NaOH溶液;D.
溶液。则加入试剂的顺序是(填序号)。
②电解NaCl饱和溶液产生的NaOH和可用于制备对新冠病毒有效消杀的“84”消毒液,写出该反应的离子方程式:。
③电解熔融可制取镁和
, 化学方程式为。其中
和
反应可制得漂白粉。漂白粉的有效成分是。
①该反应的氧化剂是,还原产物是。
②标准状况下生成 , 转移电子为mol。

该浓盐酸中, 的物质的量浓度为
。
①需量取 该浓盐酸进行配制(保留1位小数)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)。用量筒量取浓盐酸时俯视观察凹液面:。定容后经振荡、摇匀、静置,发现液面略有下降,再加适量的蒸馏水到容量瓶颈部的刻度线。

原合金中,镁的质量为g,铝的质量为g。

若Mg片不断溶解,Ti片上有无色气泡产生,则可证明TiMg(填“>”、“<”或“=”)。请写出该电池的负极的电极反应式:


从环境角度来看,用聚碳酸酯塑料代替聚乙烯和聚苯乙烯传统塑料的最大优点是。
①取m g试样A,全部溶于0.5L 2mol·L-1稀硫酸溶液中,放出11.2 L气体(已换算成标准状况),同时生成溶液B;
②另取m g试样A,加入2mol·L-1的NaOH溶液,当加到100mL时,气体不再生成;
③往溶液B中加入2mol/L NaOH,至沉淀不再发生变化。
根据以上过程回答下列问题:

郭同学认为林同学的方案可行,但考虑到如果反应结束后硫酸未保持“浓”的状态,测定结果会(填“偏大”、“偏小”或“不变”),其依据是。

2 ![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→  +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
图1  图2
图2 
①为了得到较大颗粒的晶体,加入乙酸时需要(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的操作除去了不溶性杂质,操作除去了可溶性杂质。
