已知:氨性溶液由、
和
配制。常温下,
与
形成可溶于水的配离子:
;
易被空气氧化为
;部分氢氧化物的
如下表。
|
氢氧化物 |
|
|
|
|
|
|
|
|
|
|
|
|
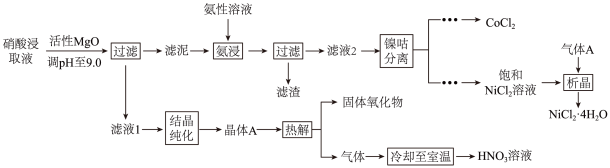
回答下列问题:
①属于(填“晶体”或“非晶体”)。
②提高了
的浸取速率,其原因是。
②由可制备
晶体,其立方晶胞如图。
与O最小间距大于
与O最小间距,x、y为整数,则
在晶胞中的位置为;晶体中一个
周围与其最近的O的个数为。
②“热解”对于从矿石提取工艺的意义,在于可重复利用
和(填化学式)。

已知:①氯化胆碱是一种铵盐;
②在溶液中常以
(蓝色)和
(粉红色)形式存在;
③时,
。
回答下列问题:
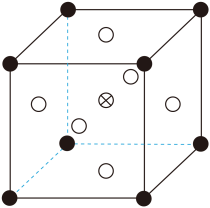
①晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为(用离子符号表示)。
②使用和
溶液可以实现
的修复,则修复过程中的化学反应方程式为。

断,你认为不正确的是____。

已知:常温下;
为第四周期第ⅤA族元素;高铼酸铵微溶于冷水,易溶于热水.
回答下列问题:

图1:高铼酸铵谱 图2

已知:①软锰矿与黄铁矿的主要成分分别为、
, 还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
金属离子 | |||||
开始沉淀的pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全( | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
回答下列问题:
滤渣1的主要成分为S、,加入后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:。

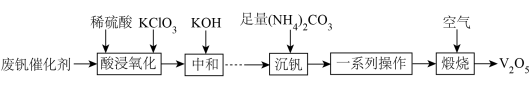
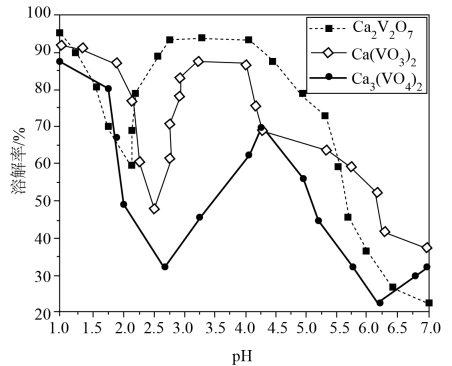
已知:
①可溶于热水,不溶于乙醇;
②常温下,部分含钒物质在水中的溶解性见下表;
物质 | ||||
溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
③+5价钒在溶液中的主要存在形式与溶液pH的关系见下表;
pH | <6 | 6~8 | 8~10 | 10~12 |
主要离子 |
回答下列问题:


已知:①25℃时,相关金属离子形成氢氧化物沉淀的
范围如下:
金属离子 | |||||
开始沉淀的 | 6.3 | 1.8 | 3.4 | 6.9 | 7.1 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 8.9 | 9.1 |
②氧化前后,溶液中、
元素的化合价均为+2价。

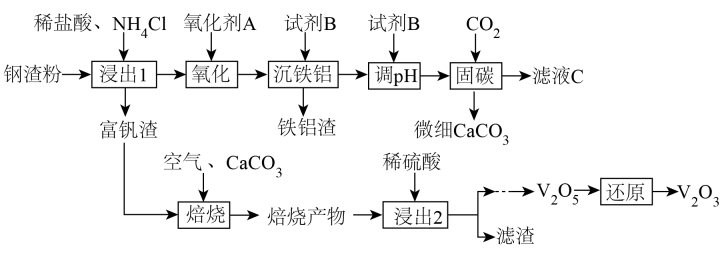
已知钢渣中元素质量分数为
在稀盐酸和
混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的
如下表所示:
金属离子 | ||||
开始沉淀的 | 1.9 | 7.2 | 3.5 | 12.4 |
沉淀完全的 | 2.9 | 8.2 | 5.1 | 13.8 |
回答下列问题: