
| 装置 | 步骤 | 操作 | 现象 |
| | ① | 打开止水夹,挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ② | 一段时间后,关闭止水夹,推动注射器活塞使部分水进入试管 | 注射器内剩余的水被“吸入”试管;铜表面产生无色气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| ③ | 一段时间后,打开止水夹,拉动注射器活塞吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
下列说法错误的是( )
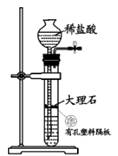 B . 除杂、干燥
B . 除杂、干燥 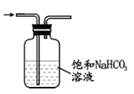 C . CO2与锌粉反应
C . CO2与锌粉反应  D . 检查 CO
D . 检查 CO 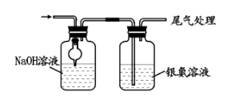
 B . 分离乙酸乙酯和饱和Na2CO3溶液
B . 分离乙酸乙酯和饱和Na2CO3溶液  C . 除去CO2中的少量HCl
C . 除去CO2中的少量HCl  D . 收集NO2
D . 收集NO2 

 用装置甲制取少量Cl2
B .
用装置甲制取少量Cl2
B .  用装置乙除去Cl2中的HCl
C .
用装置乙除去Cl2中的HCl
C .  用装置丙收集Cl2
D .
用装置丙收集Cl2
D .  用装置丁吸收尾气
用装置丁吸收尾气
 用图甲装置验证NH3易溶于水
B .
用图甲装置验证NH3易溶于水
B .  用图乙装置提纯I2
C .
用图乙装置提纯I2
C .  用图丙装置测定KMnO4溶液物质的量浓度(锥形瓶中Na2C2O4质量已知)
D .
用图丙装置测定KMnO4溶液物质的量浓度(锥形瓶中Na2C2O4质量已知)
D .  用图丁装置检验该条件下铁发生了析氢腐蚀
用图丁装置检验该条件下铁发生了析氢腐蚀
 B . 用装置乙制取无水氯化镁
B . 用装置乙制取无水氯化镁  C . 用装置丙除去氯气中的氯化氢
C . 用装置丙除去氯气中的氯化氢  D . 用装置丁分离苯和四氯化碳
D . 用装置丁分离苯和四氯化碳 
 用装置制备SO2
B .
用装置制备SO2
B .  用装置制备CuI
C .
用装置制备CuI
C .  用装置分离出CuI
D .
用装置分离出CuI
D .  用装置干燥CuI固体
用装置干燥CuI固体



 B .
B .  C .
C .  D .
D . 
 制备及收集乙烯
B .
制备及收集乙烯
B .  制备乙酸乙酯
C .
制备乙酸乙酯
C .  制备硝基苯
D .
制备硝基苯
D .  制备乙炔
制备乙炔


已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
回答下列问题:
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+ , 加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含 的质量分数表达式为。
下列关于样品组成分析的说法,正确的是(填标号)。
A. 时,样品中一定不含杂质
B. 越大,样品中
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
实验步骤如下:

步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。

已知:
| 名称 | 熔点/℃ | 沸点/℃ | 溶解性 | 理化性质 |
| 三氯氧磷 | 2 | 105.3 | 可溶于有机溶剂 | 遇水分解 |
| 氯化亚砜 | -105 | 78.8 | 可溶于有机溶剂 | 遇水分解,加热分解 |

①下列物质可代替高氯酸的是。(填序号)。
a.硫酸 b.盐酸 c.硝酸 d.磷酸
②水蒸气发生装置b的作用是。
若观察到f中溶液红色褪去,可采用最简单的补救措施是。否则会使实验结果(填“偏高”“偏低”或“不受影响”)。实验中除有 气体外,可能还有少量
(易水解)气体生成。若有
生成,实验结果将(填“偏高”“偏低”或“不受影响”)。理由是。

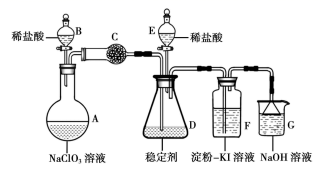
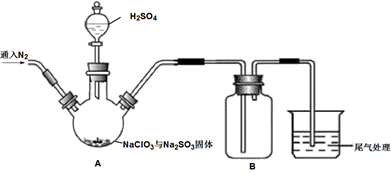
①按气流方向,上述装置合理的连接顺序为(用小写字母填空)。
②A中盛放NaNO2溶液的仪器名称为,其中发生反应的离子方程式为;m管的作用为。
③实验过程中需持续通入N2 , 其作用为。
④实验后,选用D中所得溶液和其他合理试剂,设计实验方案证明C处有Cl2生成。
①滴定终点的现象为。
②产品中VCl3与VCl2的物质的量之比为。

①烧瓶中发生反应的氧化剂和还原剂的物质的量之比为。
②装置B中的现象可以说明氧化性>,从原子结构的角度解释。

①装置E、F分别盛放和。
②E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是。
③通入氮气的作用是。

①ClO-破坏了酚酞的结构;
②。
该小组同学设计实验,取少许装置D中褪色后的溶液于试管中,请将后续操作和现象补充完整),证实了假设②不能成立。
①以上信息中可以证明氯气分子与水发生了化学反应的是,能说明反应是有一定限度的。测量pH时不能用pH试纸代替pH计,原因是。
②已知:Cl2(g)+H2O(l) H+(aq)+Cl-(aq)+HClO(aq) △H>0,该小组同学进一步探究氯气与水反应的可逆性:向20 mL饱和氯水中滴加1 mL浓硫酸,利用化学型传感器测量氯化物的含量随时间变化的关系(如图所示),从而判断溶液中Cl-的含量。

200s前,氯化物的含量突然增大的原因可能是;用平衡移动原理分析在200s后,氯化物的含量随时间减小的原因。

①样品中二氯异氰尿酸钠的质量分数为。(列出表达式即可)
②该滴定方法测得的(CNO)3Cl2Na样品的质量分数误差较大,请用离子方程式表示可能的原因。
资料:Ag+与NO 反应,可生成AgNO2白色沉淀或无色配离子。
实验i

向装置A中通入一段时间N2 , 再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
仪器a的名称是。
将实验ⅰ制取的NaNO2固体配制成约0.1 mol/L NaNO2溶液,进行实验ⅱ和ⅲ。
实验ii

①由实验ⅱ的现象得出结论:白色沉淀的生成与有关。
②仅用实验ⅱ的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是。
实验iii

②甲同学认为,依据实验ⅲ的现象可以得出结论:该条件下,NO 能氧化I-。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验ⅲ不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验ⅲ条件下氧化I-的只有NO
,实验iv的实验方案是。

ⅱ.随着反应进行,……
[进行实验]将反应后的固液混合物倒出,平均分在2个试管中,分别进行以下实验,证实了猜想ⅰ不成立。
|
序号 |
实验操作 |
实验现象 |
|
Ⅰ |
将湿润的淀粉碘化钾试纸放置于试管口,加热试管;_,充分振荡,继续加热 |
试纸未变蓝 |
|
Ⅱ |
将湿润的淀粉碘化钾试纸放置于试管口,加热试管;滴入2滴浓硫酸,充分振荡,继续加热 |
滴入浓硫酸前,试纸不变蓝;滴入浓硫酸后,试纸变蓝 |
将Ⅰ中操作补充完整:。
|
序号 |
实验装置 |
实验操作 |
现象 |
|
Ⅲ |
| 向左侧烧杯中滴加2滴浓硫酸 | 滴加浓硫酸前,电流表指针不偏转;滴加浓硫酸后,电流表指针偏转 |
| Ⅳ | 向右侧烧杯中滴加2滴浓硫酸 | 电流表指针始终不偏转 |
滴加浓硫酸后,左边烧杯中反应的电极反应式是。
|
序号 |
实验操作 |
实验现象 |
|
Ⅴ |
在0.5g二氧化锰中加入2毫升5%双氧水 |
产生气泡 |
|
Ⅵ |
在0.5g二氧化锰中滴加2滴浓硫酸,再加入2毫升5%双氧水 |
产生气泡,黑色固体消失,生成无色溶液 |
Ⅵ中反应的离子方程式是。
实验Ⅰ:制取并收集ClO2 , 装置如图所示:
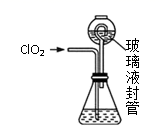
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L−1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I−+S4O62-)。
装置中玻璃液封管的作用是。
![]() +(CH3CO)2O
+(CH3CO)2O
![]() +CH3COOH
+CH3COOH
过程中发生的副反应如下:

实验步骤如下:
步骤1:在三颈烧瓶中加入3 mL苯甲醛、8 mL乙酸酐和4.2 g K2CO3固体,搅拌,控制温度在150~170 ℃,加热回流45 min。
步骤2:向反应液中分批加入20 mL水,再加入Na2CO3固体调节溶液pH至8,然后进行水蒸气蒸馏。(装置如图)

步骤3:待三颈烧瓶中的剩余液体冷却后,加入活性炭,煮沸10~15 min,趁热过滤。
步骤4:将滤液冷却至室温,用盐酸酸化,待晶体析出完全后进行抽滤,用冷水洗涤晶体,干燥得到产品。

实验步骤如下:
步骤1:向仪器A中加入11.5 mL正丁醇(微溶于水)、1 mL浓H2SO4、7.2 mL冰醋酸及沸石少许。
步骤2:按如图连接装置。

步骤3:向分水器中预先加少量水(略低于支管口)。通入冷却水,加热回流。
步骤4:将分水器分出的酯层和反应液合并转入分液漏斗中,依次用5% Na2CO3溶液、水洗涤,分离出有机相。
步骤5:将有机相用无水硫酸镁干燥、过滤、蒸馏,收集乙酸正丁酯。
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)2•6H2O。
V.将(NH4)2Fe(SO4)2•6H2O脱水得(NH4)2Fe(SO4)2 , 并进行热分解实验。
已知在不同温度下FeSO4•7H2O的溶解度如表:
|
温度(℃) |
1 |
10 |
30 |
50 |
|
溶解度(g) |
14.0 |
17.0 |
25.0 |
33.0 |
回答下列问题:
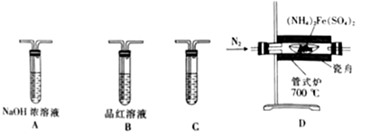
①检验气态产物中的SO2和SO3时,装置连接顺序依次为(气流从左至右);C中盛放的试剂为。
②装置A的作用是。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为。
