
由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 |
|
|
|
|
A | B | C | D |
|
选项 |
A |
B |
C |
D |
|
装置 |
|
|
|
|
|
操作及目的 |
煅烧贝壳至900℃,得到生石灰 |
浓缩海水,加生石灰反应后过滤,得到 |
蒸发 |
电解 |

A.泡豆 | B.磨浆 | C.滤渣 | D.煮浆点兑 |
|
|
|
|
已知:
;SOCl2熔点-105℃、沸点76℃,遇水剧烈水解生成两种酸性气体。
下列说法不正确的是( )
 B . 过滤
B . 过滤 C . 蒸发
C . 蒸发 D . 分液
D . 分液

选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
A |
| 加热 | |
B | 饱和 | 洗气 | |
C | 盐酸 | 过滤 | |
D | 饱和食盐水 | 洗气 |
| A | B | C | D |
| | | | |
| 分离四氯化碳与水 | 除去食盐水中的泥沙 | 制备乙酸乙酯 | 分离苯和硝基苯 |

| 选项 | A | B | C | D |
| 装置 | | | | |
| 目的 | 分离NaCl和I2的固体混合物 | 分离Fe(OH)3胶体中的FeCl3 | 除去CO2中混有的SO2 | 用乙醇萃取碘水中的碘并分离 |

具体步骤如下:
Ⅰ.称取 , 用
水溶解。
Ⅱ.分批加入后,将溶液温度降至
以下,加入
活性炭、
浓氨水,搅拌下逐滴加入
的双氧水。
Ⅲ.加热至反应
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
仪器a的名称是。加快NH4Cl溶解的操作有。

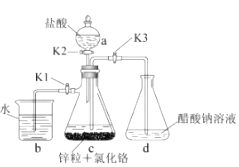
K1 , K2 , 关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为。
②同时c中有气体产生,该气体的作用是。

资料1:25℃时,生成氢氧化物沉淀的pH
| Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Mg(OH)2 | Ca(OH)2 | Ni(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 6.2 | 9.1 | 11.8 | 6.9 |
| 完全沉淀时 | 8.3 | 2.8 | 8.2 | 11.1 | 13.8 | 8.9 |
注:金属离子的起始浓度为0.1mol/L.
资料2:25℃时,Ksp(CaF2)=4×10-11 , Ksp(MgF2)=9×10-9 , ZnF2易溶于水。
资料3:P204(二乙基己基磷酸)萃取金属离子的反应为:x  +Mx+
+Mx+
 M+xH+
M+xH+


请回答下列问题:
A.SO2:70%硫酸、亚硫酸钠粉末 B.CO2:稀盐酸、大理石
C.NH3:浓氨水生石灰 D.Cl2:浓盐酸、二氧化锰

下列有关说法正确的是____(填字母)。
|
实验 |
操作与现象 |
结论 |
|
Ⅰ |
取少量Li2S样品,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 |
样品含Li2SO3 |
|
Ⅱ |
在实验Ⅰ的溶液中滴加BaCl2溶液,产生白色沉淀 |
样品含 |
①由上述实验I可知,Li2S样品中含有杂质(填化学式),产生该杂质的原因可能是。
②测定产品纯度的方法:取w g Li2S样品加入V1 mLc1 mol·L-1稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用c2mol·L-1标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液V2 mL。若该Li2S样品中杂质不参加反应,用上述方法测得的Li2S样品的纯度为%(用含V1、V2、c1、c2、w的代数式表示)。
海带→灼烧→过滤→氧化→萃取、分液→I2的CCl4溶液
上述实验流程中不需要用到的仪器是(从下列图中选择,写出名称)。

查阅资料:该反应速率与c(S2O82-)和c(I-)的关系v=kcm()cn(I-),k为常数。
实验任务:测定不同浓度下的反应速率确定所m、n的值。
实验方法:按下表体积用量V将各溶液混合,(NH4)2S2O8溶液最后加入,记录开始反应至溶液出现蓝色所用的时间t。实验过程中发生如下反应:+2I-=2
+I2(慢)I2+2
=2I-+
(快)
实验记录表:
实验编号 | A | B | C | D | E |
0.2mol·L-1(NH4)2S2O8溶液/mL | 10 | 5 | 2.5 | 10 | 10 |
0.2mol·L-1KI溶液/mL | 10 | 10 | 10 | 5 | 2.5 |
0.05mol·L-1Na2S2O3溶液/mL | 3 | 3 | 3 | 3 | 3 |
0.2mol·L-1KNO3溶液/mL | 0 | V1 | V2 | V3 | V4 |
0.2mol·L-1(NH4)2SO4溶液/mL | 0 | V5 | V6 | V7 | V8 |
0.2%淀粉溶液/mL | 1 | 1 | 1 | 1 | 1 |
t/s | t1 | t2 | t3 | t4 | t5 |
加入KNO3、(NH4)2SO4溶液的目的是控制实验条件,其中V1,V4,V5。

已知:①与
同主族,其化学性质相似。
②随着温度升高,在水溶液中的溶解度减小:
温度/ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/ | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
③本工艺流程中,不同金属离子形成氢氧化物沉淀的范围如表格所示:
金属离子 | 形成氢氧化物沉淀的 |
3.3~10.6 | |
2.9~9.4 |
回答下列问题:
 )是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(
)是合成对甲基苯甲醛(PTAL)的中间体,其沸点为270℃。利用邻苯二胺(  )和对甲基苯甲酸(
)和对甲基苯甲酸(  )合成2-(对甲基苯基)苯并咪唑的反应过程如下:
)合成2-(对甲基苯基)苯并咪唑的反应过程如下: 
向反应装置(如图)中加入0.1 mol邻苯二胺和0.15 mol对甲基苯甲酸后,再加入适量多聚磷酸(能与水互溶的质子酸),搅拌成糊状物,慢慢升温至100℃并搅拌1h,继续加热至190℃,回流2h,冷却。用10%的NaOH溶液调至微碱性,有大量固体出现,分离晶体,水洗,经重结晶提纯后,得白色针状晶体产品14.6 g.回答下列问题:


滤液3经过多次萃取与反萃取制备CoCl2晶体。

已知:
①焦亚硫酸钠Na2S2O5 , 常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 11.1 |
请回答:
已知偏铝酸盐能与一般的酸反应,如:NaAlO2+HNO3+H2O→NaNO3+Al(OH)3↓
生产流程如图:

完成下列填空:
A.  B.
B.  C.
C.  D.
D. 
说出流程中产生的滤渣的一种用途是。制作一个过滤器需要。流程中操作x的名称是。
①上述过程属于定量实验。其中除配制一定物质的量浓度的溶液外,还有一个是,该实验过程中要进行多次读数,读数的方法是读出与的刻度值。
②任意写出一个该测定过程中所涉及的化学反应的离子方程式:。
CoCl2﹒6H2O 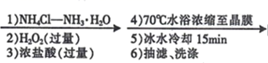 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体 
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+ Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
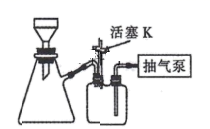
检漏→水洗→加标准液,润洗内壁→→→→→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液

已知:常温下Ksp[Fe(OH)3]=8.0×10-38 , Ksp[Al(OH)3]=3.0×10-33 , Ksp[Cu(OH)2]=3.0×10-20。

a.Cl2 b.CuO c.酸性高锰酸钾溶液 d.NaOH e.H2O2 溶液 f.K2CO3

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42- , TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液/Ml | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
4 | 0.16 | 19.88 |
则产品中乳酸亚铁晶体的纯度为(以质量分数表示)。

已知298℃时,Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cu(OH)2]=2.2×10-20 , Ksp[Mn(OH)2]=1.9×10-13 , 当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
②若将溶液b配制成250mL溶液,用滴定管取配制后的溶液25.00m1;再用a mol/L KMnO4溶液滴定,恰好反应时消耗KMnO4溶液VmL,则流程图中所得红棕色固体C的质量为g(用含a、v的代数式表示)