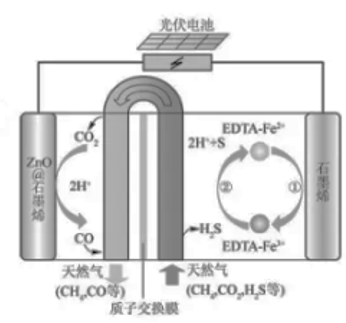
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H₂S=2H++S+2EDTA+Fe²+
该装置工作时,下列叙述错误的是( )
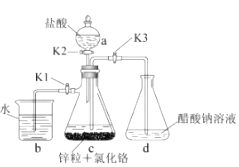
K1 , K2 , 关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为。
②同时c中有气体产生,该气体的作用是。
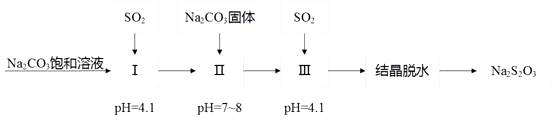 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。
②工艺中加入Na2CO3 , 固体,并再次充入SO2的目的是。

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
P/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应N2O5(g)=2NO2(g)+ O2(g)的△H= kJ·mol-1
②研究表明,N2O5(g)分解的反应速率v=2×10-3× (KPa·min-1),t=62min时,测得体系中
=2.9kPa,则此时的
= kPa,V= kPa,min-1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强pX(35℃)63.1kPa(填“大于”“等于”或“小于”),原因是。
④25℃时N2O4(g) ⇋2NO2(g)反应的平衡常数Kp= kPa (Kp为以分压表示的平衡常数,计算结果保留1位小数)。
第一步N2O5⇋NO3+NO2 快速平衡
第二步NO2+NO3⇀NO+NO2+O2 慢反应
第三步NO+NO3⇀2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
A. 
B. 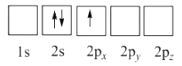
C. 
D. 
A.离子键
B.σ键
C.π键
D.氢键
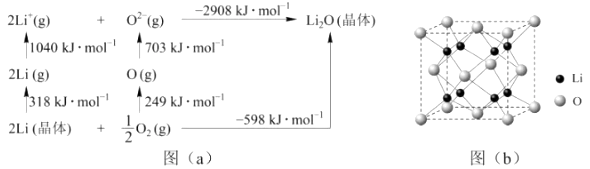
可知,Li原子的第一电离能为kJ·mol-1 , O=O键键能为kJ·mol-1 , Li2O晶格能为kJ·mol-1
伏加德罗常数的值为NA , 则Li2O的密度为 g/cm3(列出计算式)。