



 +H2O
+H2O





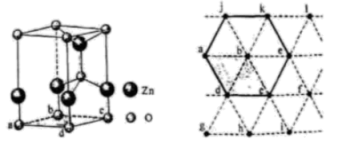
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
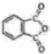 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(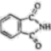 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。



该分子中碳原子的杂化轨道类型有种,N、O杂化轨道类型分别为、。

①基态的价电子排布式为。
②氢键对Q在水中溶解性的影响是(填“增大”或“减小”)。
③W与之间以共价键和配位键相结合,其中一定是配位键的是键(填“Cu—O”或“Cu—N”)。

①Y原子为(填元素符号)。与每个Y原子距离最近且等距的X原子有个。
②该晶胞边长为a nm,阿伏加德罗常数为 , 则该晶体的密度
(列出计算式,
的摩尔质量为123
)。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | -24.12 | 38.3 | 155 |

①配合物中H、C、O三种元素的电负性由大到小的排列顺序为。
②请在图中标出配位键(用“→”表示);
③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是。



①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4∙H2O晶体,该晶体中杂化轨道类型为sp3的原子为。
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:  ;Cu2+的配位数为,乙二胺沸点高于1,2﹣二氯乙烷(Cl-CH2-CH2-Cl)的主要原因是。
;Cu2+的配位数为,乙二胺沸点高于1,2﹣二氯乙烷(Cl-CH2-CH2-Cl)的主要原因是。

①该晶体的化学式为。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于(填“共价”或“离子”)化合物。
③已知该晶体的密度为ρ g/cm3 , 阿伏加德罗常数为NA , 该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离cm(列计算式即可)。
请回答下列问题:
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是。
②CH4、HCHO的键角较大的是,主要原因是。

①钴晶胞堆积方式的名称为。
②已知白铜晶胞的密度为d g·cm-3 , NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为 pm(只列出计算式)。


![]()
请判断该排布图(填“正确”或“不正确”),理由是(若判断正确,该空不用回答)。

①在该晶胞中,Cu+的配位数是。
②若该晶胞的边长为apm,则Cu2O的密度为g·cm-3(只要求列算式,设阿伏加德罗常数为NA)

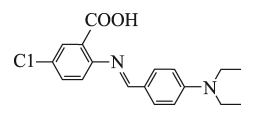
①分子中含苯环和碳氮双键,能发生银镜反应;
②分子中有4种不同化学环境的氢原子。
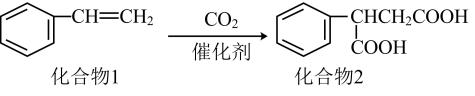
 的合成路线(无机试剂和有机溶剂任选,合成路线示例见本题题干)。
的合成路线(无机试剂和有机溶剂任选,合成路线示例见本题题干)。