


 +RZnCl=
+RZnCl=  +ZnCl2
+ZnCl2






在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是,中心原子杂化类型为,属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为,共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为,S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
①M中同周期元素第一电离能由大到小的顺序为,原因为。
②M中结构片段“ ![]() ”中4个碳原子共线的原因为。
”中4个碳原子共线的原因为。
③M中的“ COOH”被称之为亲水基的原因为。

图I和图Ⅱ的堆积方式分别为和;二者的空间利用率之比为。

①写出该含汞化合物的化学式。
②M中 (填“大于”、“小于”、或“等于”)NH3中的
,分析原因。
③该含汞化合物晶体在水中的溶解性(填“可溶”或“难溶”),分析原因。
④在晶胞中Cl原子a的分数坐标为( ,
,1),则Hg原子b的分数坐标为;晶胞的体积为V cm3 , 则该晶体的密度为
。
回答下列问题:
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”、“变小”或“不变”),原因是。

①TiO2晶胞中O2-的配位数是。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为、。
③已知二氧化锆晶胞的密度为ρ g·cm-3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为;


 )中共价键的类型是,每个分子中含个σ键。
)中共价键的类型是,每个分子中含个σ键。

a.将新制氯水滴到一块红纸上,红纸很快褪色,起作用的主要微粒是;
b.将新制氯水滴加到FeCl2溶液中,溶液变黄,该现象说明氯水有(填“氧化”或者“还原”)性;
资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。

该流程中能循环使用的物质是。

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为;


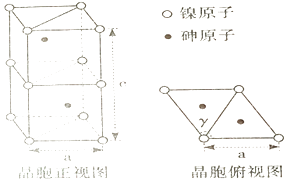
①镍原子配位数为,配原子构成的几何体是。
②该晶体密度的计算式为g·cm-3。

