| 实验操作 | 现象 | 结论 | |
| A. | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的 | 无砖红色沉淀 | 蔗糖未发生水解 |
| B. | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| C. | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入 | 铁锈中含有二价铁 |
| D. | 向 | 先产生白色沉淀,滴入 | |


实验操作 | 实验现象 | 结论 | |
A | 将Fe3O4粉末溶于盐酸,再向其中加入少量酸性KMnO4溶液 | KMnO4溶液褪色 | Fe3O4中含有Fe(II) |
B | 向淀粉溶液中加入稀硫酸,水浴加热后,再加入少量新制氢氧化铜,加热 | 产生砖红色沉淀 | 淀粉的水解产物中有葡萄糖 |
C | NaHCO3溶液与NaAlO2溶液混合 | 产生白色沉淀 | 结合H+的能力: |
D | 向10mL0.1mol·L-1AgNO3溶液中先加入5mL0.1mol·L-1KCl溶液,再加入5mL1mol·L-1KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
选项 | 实验 | 实验说明或者方案设计 |
A | 测定中和反应的反应热 | 中和滴定的同时,使用温度传感器采集锥形瓶内溶液温度,测得中和反应的反应热数值可能偏低 |
B | 比较Mg和Al的金属性强弱 | 将MgCl2溶液和AlCl3溶液分别与足量NaOH溶液反应 |
C | 实验室制备氢氧化铁胶体 |
|
D | 室温下,将AgCl和AgBr的饱和溶液等体积混合 | 已知Ksp(AgCl)=1.8×10-10 , Ksp(AgBr)=5.0×10-13 , 推测可能看到出现淡黄色沉淀 |

已知: K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,难溶于醇等有机溶剂。下列说法错误的是:( )
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中先滴加稀硝酸,再滴加 | 该溶液中一定含有 |
B | 向 |
|
C | 向 | |
D | 用 | 酸性: |
选项 | 操作 | 现象 | 结论 |
A | 两块相同的未经打磨的铝片,相同温度下分别投入5.0mL等浓度的 | 前者无明显现象,后者剧烈反应 |
|
B | 向 | 白色沉淀转化为淡黄色沉淀 | |
C | 取少量溶液于试管中,先加入KSCN溶液,再滴加过量酸性高锰酸钾溶液 | 溶液变红色 | 溶液中含Fe2+ |
D | 向铜与浓硫酸反应后的溶液中加入适量水稀释 | 溶液呈蓝色 | 溶液中存在 |

下列有关W的叙述错误的是( )
编号 | 实验操作 | 实验结论 |
A | 室温下,用pH试纸测定浓度均为 | 两溶液中水的电离程度相同 |
B | 向饱和 | 酸性: |
C | 将 |
|
D | 相同温度下,向浓度均为 |
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以
存在。
回答下列问题:
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2 , 当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
i.准确称取mg的产品,配制成100mL溶液,移取20mL于锥形瓶中;.
ii.滴加几滴K2CrO4溶液为指示剂,用c mol· L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl 1.3×10-6mol · L-1 , Ag2CrO4(砖红色)6.5×10-5mol ·L-1
①ii中,滴定至终点的现象是。
②制备的晶体中Cl-的质量分数是(列计算式即可)。
A.乙醇|B.HNO3溶液 C.盐酸 D.NaOH 溶液
AgCl(s)Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
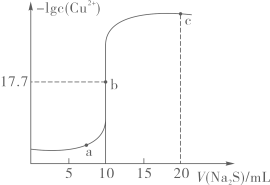
①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为;
②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:。

内,浸出
元素的主要离子方程式为。


527.4℃时,生成相应固体物质的化学方程式为。
①不做任何实验就可以肯定原溶液中不存在的离子是。
②取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是。
③取②的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是。
④原溶液可能大量存在的阴离子是下列A~D中的(填标号)。
A. B.
C.
D.
①写出水解的离子方程式。
②向相同体积、相同浓度的和
溶液中分别滴加
的盐酸,溶液pH变化如下图所示。

a.图 (填“甲”或“乙”)是的滴定曲线。
b.A′~B′的离子方程式为。写出A′溶液中各离子浓度由大到小的顺序。
c.A、B、C三点溶液中,水的电离程度由大到小的顺序为。
③向的
和
溶液中分别滴加少量
溶液,均产生白色沉淀,后者有气体产生,且白色沉淀的成分只有一种。已知:
i.的
溶液中,
,
ii.25℃时, ,
写出向溶液中滴加少量
溶液发生的离子反应方程式。

已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为、
、
;
②不同pH下,V(V)在溶液中的主要存在形式见下表:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
③25℃时,。
回答下列问题:
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01mol·L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(c=1.0×10−5mol·L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
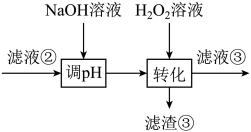

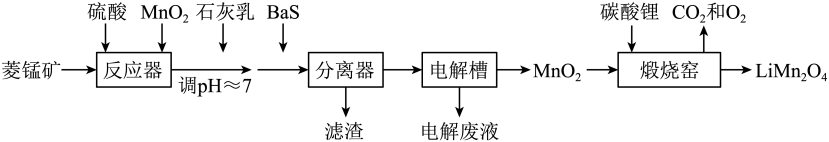
已知:“焙烧”中,、
几乎不发生反应,
、MgO、CaO、
转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子 | ||||
开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( | 3.2 | 4.7 | 11.1 | 13.8 |
回答下列问题:

已知:①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液:“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
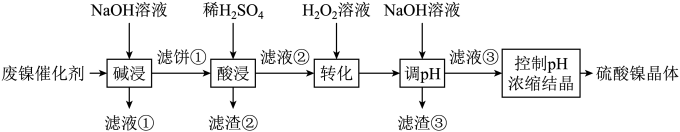
回答下列问题:
已知:①浸出液中含有的阳离子有H+、Co2+、 Fe2+、 Mn2+、 Ca2+、Mg2+、Al3+等。
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:

沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 | 10.9 |

A.1.0-1.5 B.3.0-3.5 C.5.0-5.5 D.6.0-6.5

回答下列问题:
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是(填字母)。
A.适量的N2 B.NaNO2 C.油脂 D.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是。若缓蚀剂为钼酸钠一月桂酰肌氨酸(总浓度为300mg·L-1),缓蚀效果最好时,钼酸钠(M=206g·mol-1)的物质的量浓度为mol·L-1(保留2位有效数字)。