。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强( | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法正确的是( )
反应①:
反应②:
总反应③:
反应②的。

①催化剂效果最佳的反应是(填“反应Ⅰ”“反应Ⅱ”、“反应Ⅲ”)。
②一定温度下,下列不能说明上述反应Ⅰ达到化学平衡状态的是。
A.的质量分数在混合气体中保持不变
B.反应中与
的物质的量之比为
C.
D.容器内气体总压强不再变化
E.容器内混合气体的密度不再变化
③若反应Ⅲ在a点时已达平衡状态,a点的转化率高于b点和c点的原因是。
④c点时总压强为0.1MPa,该反应的平衡常数=(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果用最简分式表示)。

①多孔电极a的电极反应式为。
②若生成的和
的物质的量之比为
, 则消耗相同状况下的
和
体积比为。
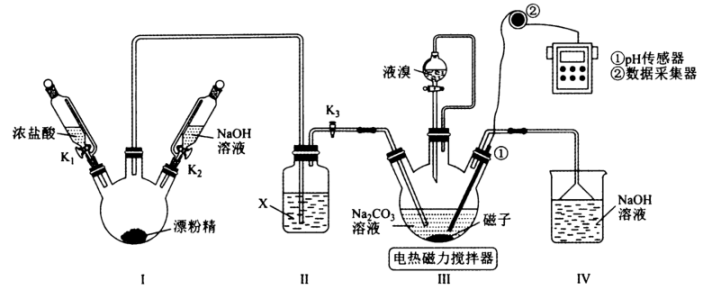

下列有关说法正确的是(填序号)。
a.选择图甲装置的优点是避免过滤过程中析出晶体
b.分离过程为:趁热过滤,蒸发结晶,抽滤,洗涤,干燥
c.选择图乙装置的优点是抽滤速率快,使产品更加干燥
判断达到滴定终点的现象为。产品质量分数为(用含a , c , V的代数式表示)。
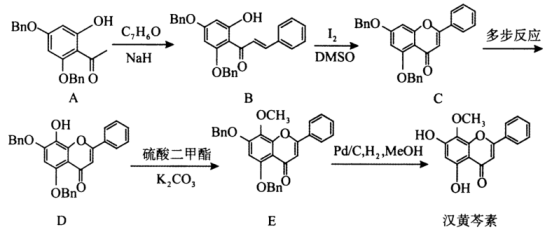
已知信息:①代表苄基
![]()
②硫酸二甲酯的结构简式为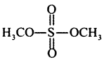
③![]()
 )有多种同分异构体,能同时满足以下条件的芳香化合物的同分异构体有种;
)有多种同分异构体,能同时满足以下条件的芳香化合物的同分异构体有种; ①含有酯基且不能发生银镜反应
②1mol该物质与足量Na反应生成
其中核磁共振氢谱有四组峰,峰面积之比为的结构简式为(任写一种)。