氧化还原电对(氧化型/还原型) | 电极反应式 | 标准电极电势 |
0.77 | ||
0.54 | ||
1.36 | ||
1.07 | ||
0.151 |
下列分析错误的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 取5mL0.1mol/LFeCl3溶液,滴加5~6滴0.1mol/LKI溶液,充分反应后,再滴加KSCN溶液 | 溶液变红 | FeCl3和KI的反应是可逆反应 |
B | 将足量SO2通入Na2CO3溶液中逸出的气体通入足量的酸性KMnO4溶液,再通入澄清石灰水中 | 酸性KMnO4溶液颜色变浅,澄清石灰水变浑浊 | Ka1(H2SO3)>Ka1(H2CO3) |
C | 将脱脂棉放入试管中,加入浓硫酸后搅成糊状,微热得到亮棕色溶液,加入新制Cu(OH)2悬浊液,加热 | 有砖红色沉淀生成 | 说明水解产物含有葡萄糖 |
D | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
①向1mL0.15mol·L-1的KSCN溶液中加入1mL0.15mol·L-1FeSO4溶液,无明显现象。
②向①中所得溶液再滴加硫酸酸化的KMnO4溶液,溶液先变红后褪色。
③向1mL 0.15mol·L-1的KSCN溶液中加入1mL 0.05mol·L-1Fe2(SO4)3溶液,溶液变红。
④向③中所得溶液再滴加0.5mL 0.5mol·L-1FeSO4溶液,溶液颜色明显变浅。
下列说法错误的是( )

选项 | 实验目的 | 选用试剂(或操作) | 实验装置 |
A | 验证Fe2+和Br-的还原性强弱 | 取适量FeBr2溶液,通入少量Cl2(不能与任何微粒完全反应),一段时间后,将溶液放入CCl4中摇匀、静置 | 甲 |
B | 制备氢氧化亚铁 | 取新制FeSO4溶液,滴加NaOH溶液 | 乙 |
C | 除去CO2中少量的SO2、H2O(g) | 试剂a为饱和碳酸钠溶液 | 丙 |
D | 制备AlCl3固体 | 蒸发AlCl3饱和溶液 | 丁 |
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 紫红色退去 |
|
B | 加热某盐与 | 红色石蕊试纸变蓝 | 该盐为铵盐 |
C | 将用硫酸酸化的 | 溶液变黄色 | 氧化性: |
D | 向一定浓度的 | 产生黑色沉淀 |
|



| 选项 | 实验操作和现象 | 结论 |
| A | 乙醇钠的水溶液呈强碱性 | |
| B | 将某溶液滴在 | 原溶液中一定含有 |
| C | 向 | 氧化性: |
| D | 向盛有 | |
| 选项 | 实验操作和实验现象 | 结论 |
| A | 向 | 氧化性: |
| B | 向盛某盐溶液的试管中滴入浓氢氧化钠溶液并加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含有 |
| C | 将稀盐酸滴入 | 非金属性: |
| D | 将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊 | 碳被氧化成 |
选项 | 实验目的 | 实验操作 |
A | 测定 | 将固体溶于水配制成溶液,分别以酚酞和甲基橙为指示剂,用标准盐酸滴定 |
B | 比较HClO与 | 用pH计测量相同浓度NaClO溶液和 |
C | 提纯混有 | 将固体溶于水,蒸发浓缩,冷却结晶、过滤 |
D | 比较 | 向KBr、KI混合溶液中依次加入少量氯水和 |
| 选项 | 实验 | 现象 | 结论 |
| A | 向 | 生成两种沉淀 | |
| B | 向浓度均为 | 先出现浅蓝色沉淀 | |
| C | 向 | 有气体产生,一段时间后, | |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
| 加入溶液 | ①适量铋酸钠溶液 | ②过量双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液缓慢变成蓝色 |
在上述实验条件下,下列结论正确的是( )
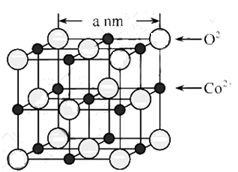

A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4

①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂(填氧化剂化学式)氧化性减弱。
猜想b:在此反应中,减弱。
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
实验序号 | 操作 | 有无氯气生成 |
1 | 加入较浓硫酸,使 | 有氯气 |
2 | 加入NaCl固体,使 | 有氯气 |
3 | 无氯气 |
⑤数据分析,得出结论 猜想a、猜想b和猜想c均正确。
⑥迁移应用 25℃时,。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2 , 依据②中信息,可能的原因是:。
①Se转化为H2SeO3 , 化学方程式为。
②Ag2Se转化为AgCl,从化学平衡的角度解释原因。
②Cl2、SO2、H2SeO3氧化性由强到弱的顺序为。
第一步:2Cu2++4I-=2CuI↓+I2。
第二步:2(无色)+I2=
(无色)+2I-
①由此可知滴定所用的指示剂为。
②已知CuSO4溶液体积为25mL,滴定至终点时消耗cmol·L-1Na2S2O3溶液VmL,则CuSO4溶液的物质的量浓度为mol·L-1。
③若使用的KI溶液过量,对滴定结果的影响是(填“偏大”或“偏小”或“不影响”)。
下列试剂能实现转化的是____。
已知:
为无色,在空气中极易被氧化为
物质 | CuCl(白色) | CuI(白色) |
| CuS(黑色) |
Ksp |
实验如下:
实验a | 实验b | ||
| 现象:无明显变化 |
| 现象:产生白色沉淀 |
实验a中反应难以发生的原因是。
①甲预测的理由是。
②为了验证猜测,甲进行实验c;向溶液中加入KI溶液,观察到溶液变为棕色,并伴有浑浊产生。
甲认为仅依据溶液变为棕色这一现象,无法证明实现了转化,理由是。
③甲将实验c中反应所得浊液过滤,,观察到,证明实验c中实现了转化。
①从速率角度分析与
反应没有生成
的原因。
②乙利用上述实验中的试剂,改进实验方案,证明在一定条件下可以将
转化为+1价Cu,并进一步得到了
, 实验方案是。