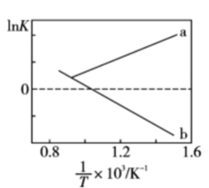
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
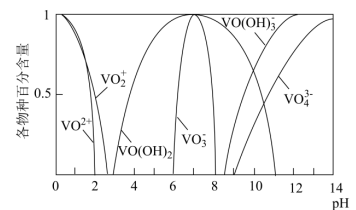
②![]() 完全沉淀的pH为8.4;
完全沉淀的pH为8.4;![]() 完全溶解的pH约为11。
完全溶解的pH约为11。
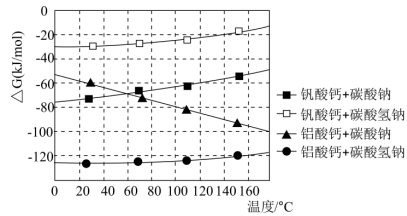
③吉布斯自由能(![]() )可以用来判断反应进行的方向。一个反应的
)可以用来判断反应进行的方向。一个反应的越小,反应发生的可能性越大。
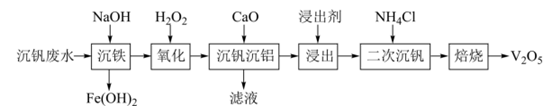
②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入 , 可大大提高钒的浸出率,原因是。
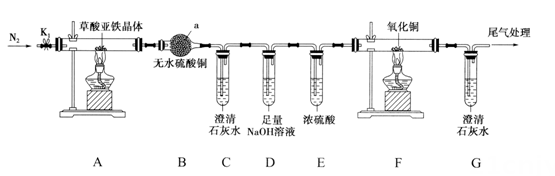 回答下列问题:
回答下列问题:

①准确量取25.00mL样品溶液的玻璃仪器是;第二次滴定达到终点的现象是。
②以M为草酸亚铁晶体的相对质量,该样品的纯度为(用代数式表示),若配制溶液时被氧化,则测定结果将(填“偏高”“偏低”或“不变”)。

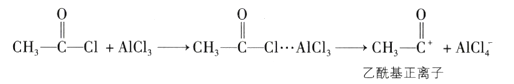
①乙酰氯分子中碳原子的杂化类型为。
②乙酰氯分子中C—C键与C—Cl键的夹角120°(填“大于”“等于”或“小于”),判断理由是。
③的空间构型为。
 (若不看
(若不看(Ⅰ)
(II)
(III)
回答下列问题: