 B .
B .  D .
D . 
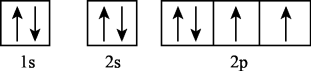
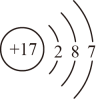 C . 基态碳原子价层电子轨道表示式为:
C . 基态碳原子价层电子轨道表示式为: D . 基态N原子的价层电子排布图:
D . 基态N原子的价层电子排布图:
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
R |
740 |
1500 |
7700 |
10500 |
…… |
①R的最高正价为+3价 ②R元素基态原子的电子排布式为1s22s2
③R元素第一电离能大于同周期相邻元素 ④R元素位于元素周期表中第ⅡA族



A.干冰 B.金刚石 C.氦 D.过氧化钠 E.二氧化硅 F.溴化铵 G. H2O2 H.氢氧化钠


2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:

