本题中所涉及离子的氯氧化物溶度积常数如下表:
|
离子 |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
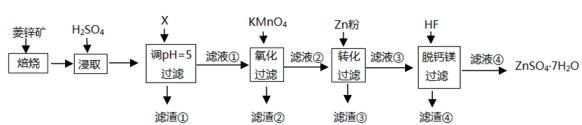
滤渣①的主要成分是、、。

(ⅰ)直接氯化:
(ⅱ)碳氯化:①反应
的
为
,
。
②碳氯化的反应趋势远大于直接氯化,其原因是。
③对于碳氯化反应:增大压强,平衡移动(填“向左”“向右”或“不”);温度升高,平衡转化率(填“变大”“变小”或“不变”)。
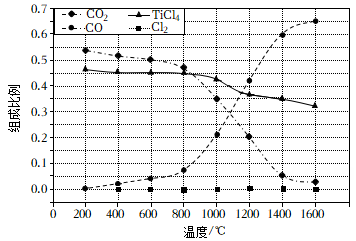
①反应的平衡常数
。
②图中显示,在平衡时
几乎完全转化为
, 但实际生产中反应温度却远高于此温度,其原因是。
2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:


用N-杂环卡其碱(NHC base)作为催化剂,可合成多环化合物。下面是一种多环化合物H的合成路线(无需考虑部分中间体的立体化学)。
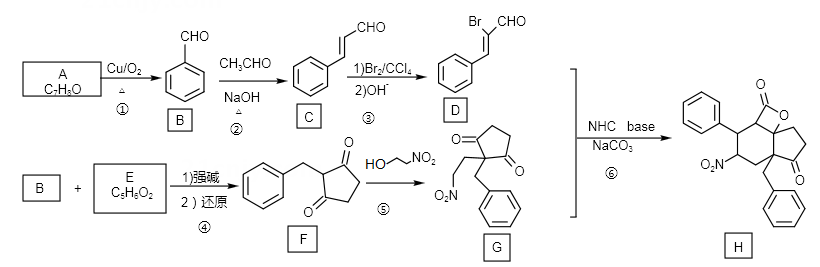
回答下列问题:
 ),参照上述合成路线,写出相应的
),参照上述合成路线,写出相应的