下列叙述错误的是( )
方法I:氨热分解法制氢气
相关化学键的键能数据
|
化学键 |
| | |
| 键能 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将 分解为
和
。回答下列问题:
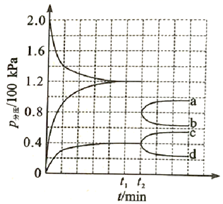
①若保持容器体积不变, 时反应达到平衡,用
的浓度变化表示
时间内的反应速率
(用含
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应
,
,其中
,
、
、
、
为各组分的平衡分压)。
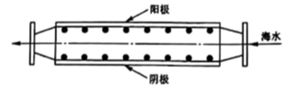
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。

KOH溶液KOH溶液
|
物质 |
H2(g) |
C(石墨,s) |
C6H6(l) |
|
燃烧热△H(kJ•mol-1) |
-285.8 |
-393.5 |
-3267.5 |
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1 , 当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于kPa。
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O
=CO2+CO
Ⅲ. Ⅳ.CO +2Li+=Li2CO3
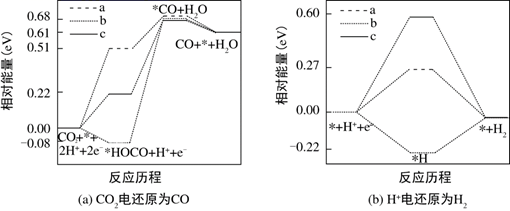
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为。
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为(用a、b、c字母排序)。

I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:

该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全(c=1.0×10*mol-L')的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
2NO(g)+2ICl(g) 2NOCl(g)+I2(g) KP1
2NOCl(g) 2NO(g)+Cl2(g) KP2
得到lgKP1
和lgKP2
均为线性关系,如下图所示:

①由图可知,NOCl分解为NO和Cl2反应的ΔH0(填“大于”或“小于”).
②反应2ICl(g)=Cl2(g)+I2(g)的K=(用KP1、KP2表示):该反应的ΔH0(填“大于”或“小于”),写出推理过程.
NOCl+hv→NOC*
NOCl+NOCl*→2NO+Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收mol的光子。
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
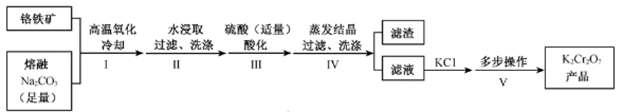
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
Cr2O
+H2O
相关物质的溶解度随温度变化如下图。
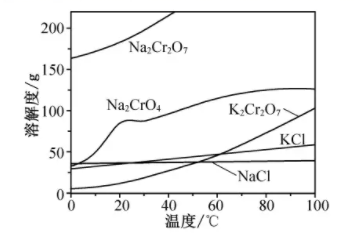
请回答:
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)