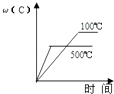
 B .
B . 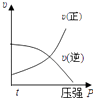 C .
C . 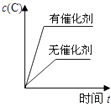 D .
D . 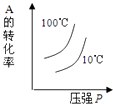
①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.

在一密闭容器中发生反应2NO2⇌2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.

请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为.
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是(填“浓度”、“压强”、“温度”或“催化剂”).
①2N2O5(g)⇌4NO2(g)+O2(g)
②2NO2(g)⇌2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4mol•L﹣1 , c(O2)=1.3mol•L﹣1 , 则反应②中NO2的转化率为,N2O5(g)的起始浓度应不低于 mol•L﹣1 .
化学式 | HF | H2CO3 | HClO |
电离平衡常数(Ka) | 7.2×10﹣4 | K1=4.4×10﹣7 K2=4.7×10﹣11 | 3.0×10﹣8 |

