

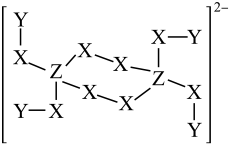






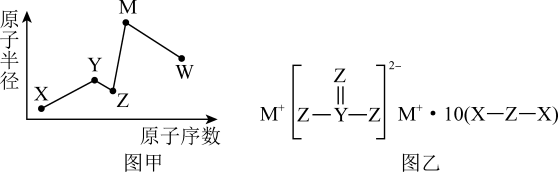
元素 | X | Y | Z | M |
性质或结构信息 | 原子核外有三个能级,每个能级含有的电子数都相等 | 原子核外有两个电子层,最外层有3个未成对电子 | 氢化物为二元弱酸 | 基态原子核外价电子排布式为 |
下列说法错误的是
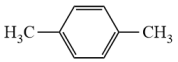 等
B . 液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C . 煤炭的清洁化利用:煤炭→
等
B . 液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C . 煤炭的清洁化利用:煤炭→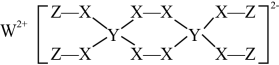


该化合物的化学式为,在晶体中与Cu距离最近且相等的Cu有个,若该晶体密度为
, 化合物式量为M,则该晶体中Cu原子与Br原子的最小核间距为pm(写出表达式,阿伏加德罗常数为
)。
①中涉及的元素H、B、N电负性最大的是。
②键角:(填“>”、“<”或“=”),原因是。

①距离Mg原子最近的Fe原子个数是。
②若该晶胞的棱长为anm,阿伏加德罗常数的值为 , 则该合金的密度为
。
③若该晶体储氢时,分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下
的体积约为L。
①[Cu(NH3)4]2+的H—N—H键角(填“>”、“=”或“<”)NH3的H-N-H键角。
②若[Cu(NH3)4]2+中两个NH3分别被Cl-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2Cl2:

[Cu(NH3)4]2+的空间构型是;在水中的溶解度:(m)(n)(填“>”、“=”或“<”)。
③NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是。


5B 2.0 | 6C 2.5 | 7N 3.0 | 8O 3.5 | 9F 4.0 |
13Al 1.5 | 14Si 1.8 | 15P 2.1 | 16S 2.5 | 17Cl 3.0 |
31Ga 1.6 | 32Ge 1.8 | 33As 2.0 | 34Se 2.4 | 35Br 2.8 |
下列含铝化合物属于离子化合物的是____(填标号)。
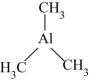 )是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。
)是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。①三甲基铝分子中C原子的VSEPR模型为,Al原子的杂化轨道类型为。
②该物质可与胺类( , R表示烃基)结合,原因是。
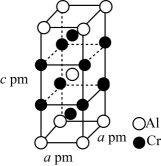
①该合鑫Cr-Al晶体的化学式为。
②用NA表示阿伏加德罗常数的值,则合金Cr-Al晶体的密度为(写出计算式即可,不要求化简)。

已知:I.CuS、PbS的Ksp分别为6.3×10-36、9.0×10-29;
II.As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
