| 选项 | 目的 | 实验 |
| A | 制取较高浓度的次氯酸溶液 | 将Cl2通入碳酸钠溶液中 |
| B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
| C | 除去乙酸乙酯中的少量乙酸 | 加入饱和碳酸钠溶液洗涤、分液 |
| D | 制备少量二氧化硫气体 | 向饱和亚硫酸钠溶液中滴加浓硫酸 |
| 实验操作 | 实验现象 | |
| A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
| B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
| C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
| D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |




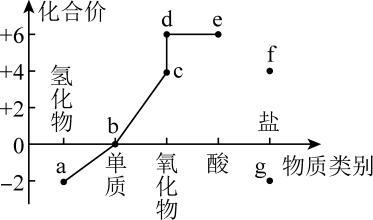


①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的(填化学式)。
③沉淀器中反应的离子方程式为。

已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。


①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: ,用少量无水乙醇洗涤,干燥,密封包装。
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③ | ④,有刺激性气体产生 |
⑤静置, | ⑥ |
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
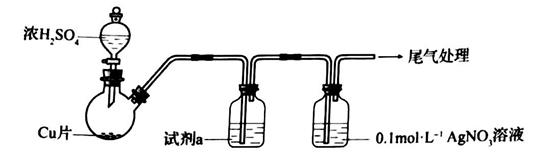
①浓 与Cu反应的化学方程式是
②试剂a是。
(资料: 微溶于水;
难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有
。向滤液E中加入一种试剂,可进一步证实B中含有
。所用试剂及现象是。
途径1:实验一中, 在
溶液中被氧化生成
,随沉淀B进入D。
途径2:实验二中, 被氧化为
进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
。做出判断的理由:。
②实验三的结论:。
根据上述实验所得结论:。
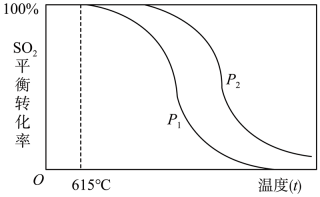
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。

配平步骤①涉及到的方程式(先在括号里补齐生成物):
_Fe2 (SO4)3 + _ H2S =_FeSO4 +_S↓ +_

①写出装置C中反应的离子方程式。
②该流程中可以循环利用的物质是(填写化学式)。

①该小组采用下图装置在实验室测定模拟烟气中的体积分数,X溶液可以是(选填字母)。

a.碘的淀粉溶液 b.酸性高锰酸钾溶液 c.氢氧化钠溶液 d.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中氧化成
的转化率。已知气体流速,还需测定的数据有、。
A.CaSO4·2H2O B.Na2SO4·10H2O C.FeS2 D.CuFeS2

①试剂a可选用下列溶液中的(填字母标号)。
A.稀硫酸 B.H2SO3溶液 C.H2O2溶液 D.FeCl2溶液
②该实验的尾气处理不宜采用点燃法,其原因是。
①移开玻璃棒后的实验现象为。
②欲将上述生成的FeS纯化,首先采用磁选法除去剩余的铁粉,然后用(填试剂化学式)将残留的硫粉溶解,随后进行分离、干燥、称重,得到纯净的FeS 2.2 g,则该反应的产率=。
①从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填字母标号)。
a. Na2S+S b. Na2SO3+S c. SO2+ Na2SO4 d. Na2SO3+ Na2SO4
②Na2S2O3在空气中易氧化变质,设计实验证明某硫代硫酸钠样品已变质。

 。
。①与试剂相比,
一石墨烯/
的使用范围更广。
在强碱性条件下反应生成·OH,写出该反应的离子方程式:。
②一种制取一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)

在石墨烯表面制得1mol , 理论上需要消耗
的物质的量为mol。
③利用该复合材料催化活化并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为。
