中C元素的化合价是,写出
的电离方程式。

①三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解,
是一种稳定的配离子,能类似于
中的
在溶液中稳定存在。
和
存在如下平衡:
ⅰ.
ⅱ.
②相同条件下,草酸根(C2O)的还原性强于
③为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
操作 | 现象 |
在避光处,向10mL 0.5 | 得到翠绿色溶液和翠绿色晶体 |
取实验中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,原因是(结合ⅰ、ⅱ平衡,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与
结合使ⅱ平衡移动(填“正向”或“逆向”)。经检验发现上述实验中
和
未发生氧化还原反应。

已知:在水中的溶解度不大,且溶解度随温度升高而减小。
序号 | 酸 | 氧化剂 | 浸出液 | 滤渣中Li含量/% |
实验1 | HCl | 9.02 | 0.10 | |
实验2 | HCl | 9.05 | 0.08 | |
实验3 | HCl | 7.05 | 0.93 |
实验2中,可与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量。综合考虑
的浸出率及环保因素,选择的氧化剂最好为。
 )为原料制取磷酸亚铁锂。
)为原料制取磷酸亚铁锂。
①
②
上述反应中C(ads)为吸附活性炭,反应历程的能量变化如图所示:

-
干重整反应的热化学方程式为(选用
、
、
、
、
的关系式表示反应热),反应Ⅱ是(填“慢反应”或“快反应”)。
③
④
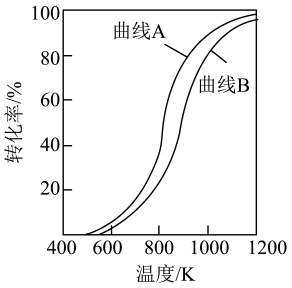
如图所示,压强为kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中
的物质的量,原因是。




已知:同一碳原子上连两个羟基时不稳定,易发生反应:。
请回答下列问题:
 )在一定条件下可转化为H(
)在一定条件下可转化为H( ),两者性质如下表所示。
),两者性质如下表所示。物质 | 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
| 3-溴-4-羟基苯甲醛 | 201.02 | 130~135 | 261.3 |
| 3,4-二羟基苯甲醛 | 138.2 | 153~154 | 295.42 |
H相对分子质量小于C,熔沸点却高于C,原因是。
条件:①与溶液发生显色反应;②能发生水解反应;③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰面积比为3:2:2:1的结构简式为(写一种即可)。
 和乙酸为原料制备
和乙酸为原料制备 的合成路线 (其他试剂任选)。
的合成路线 (其他试剂任选)。