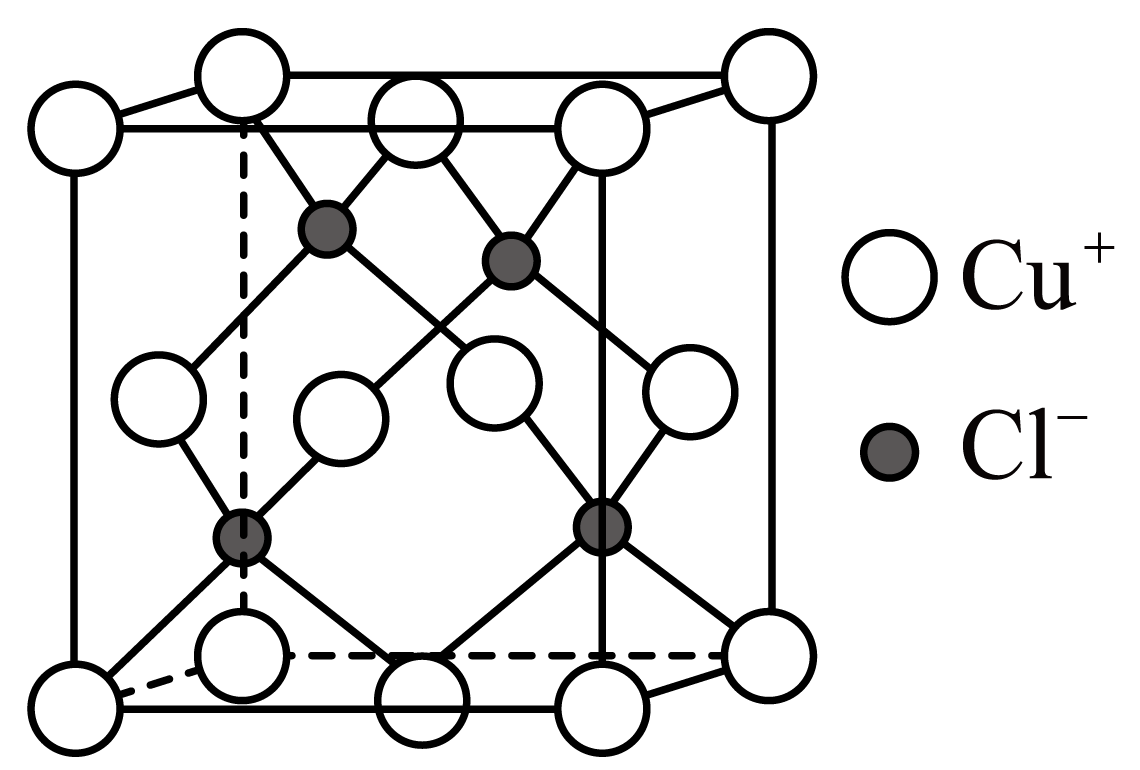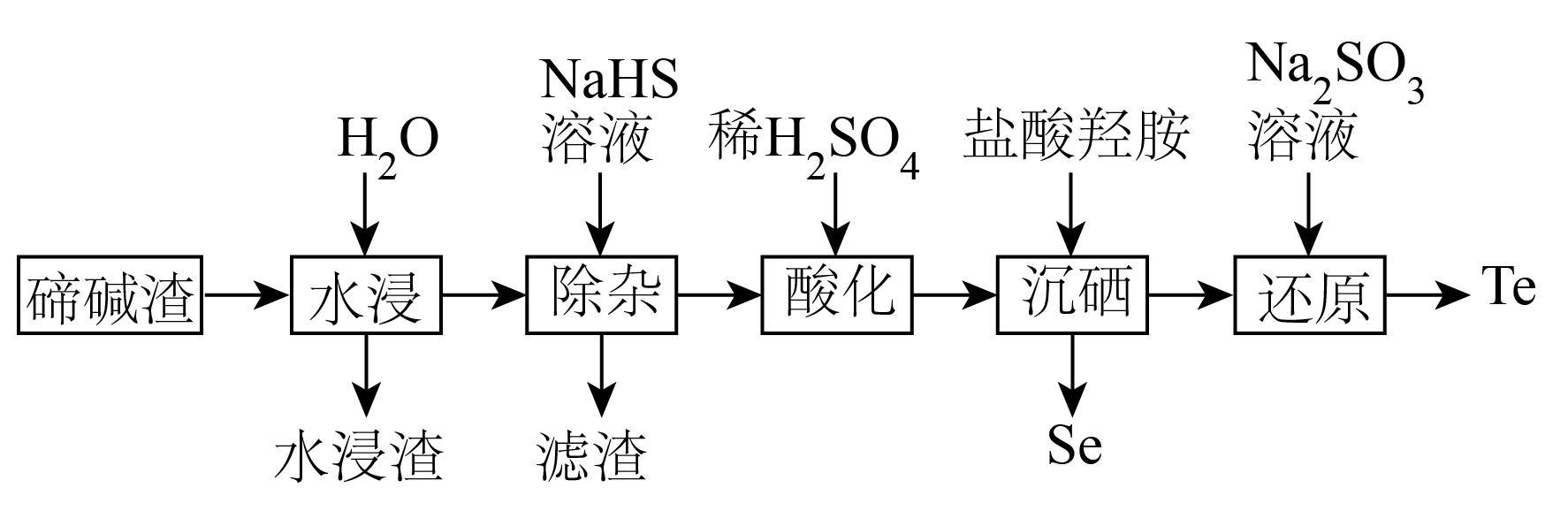
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题:
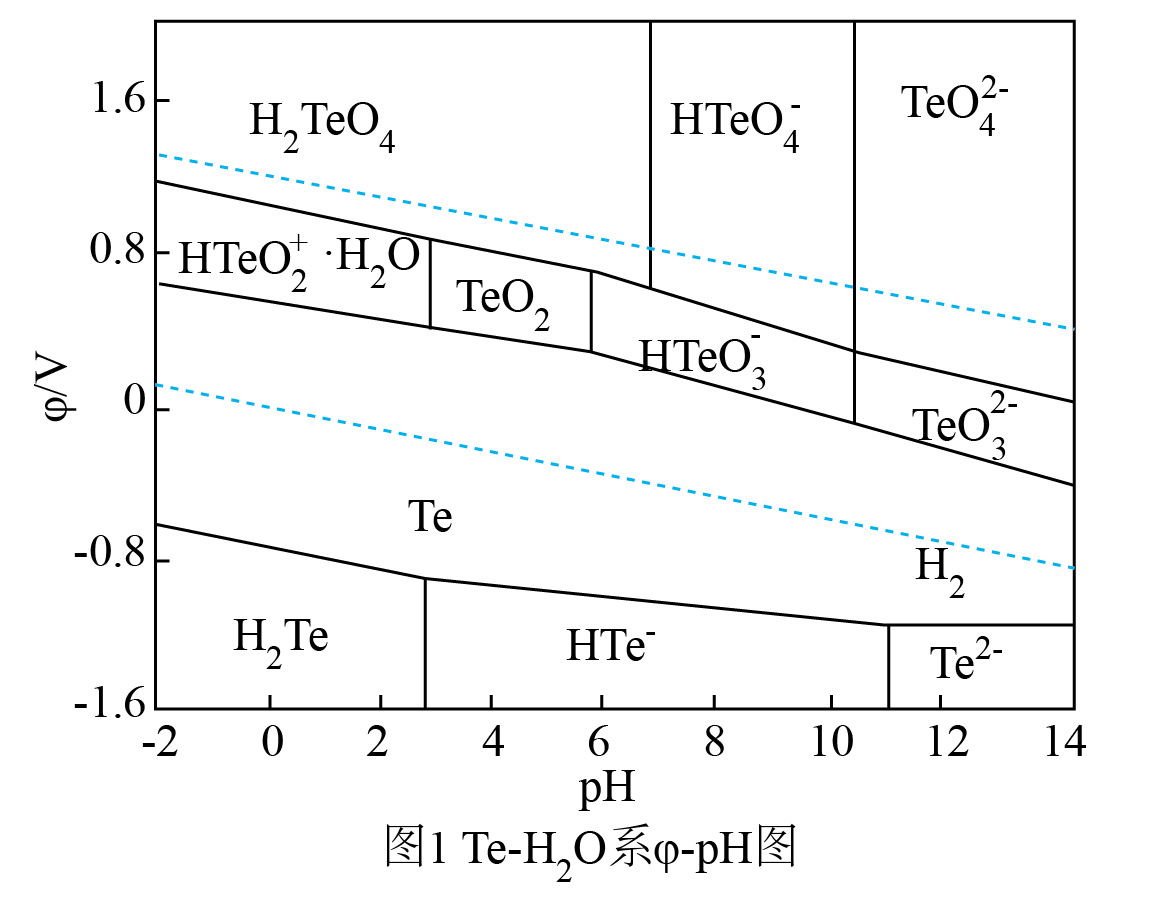
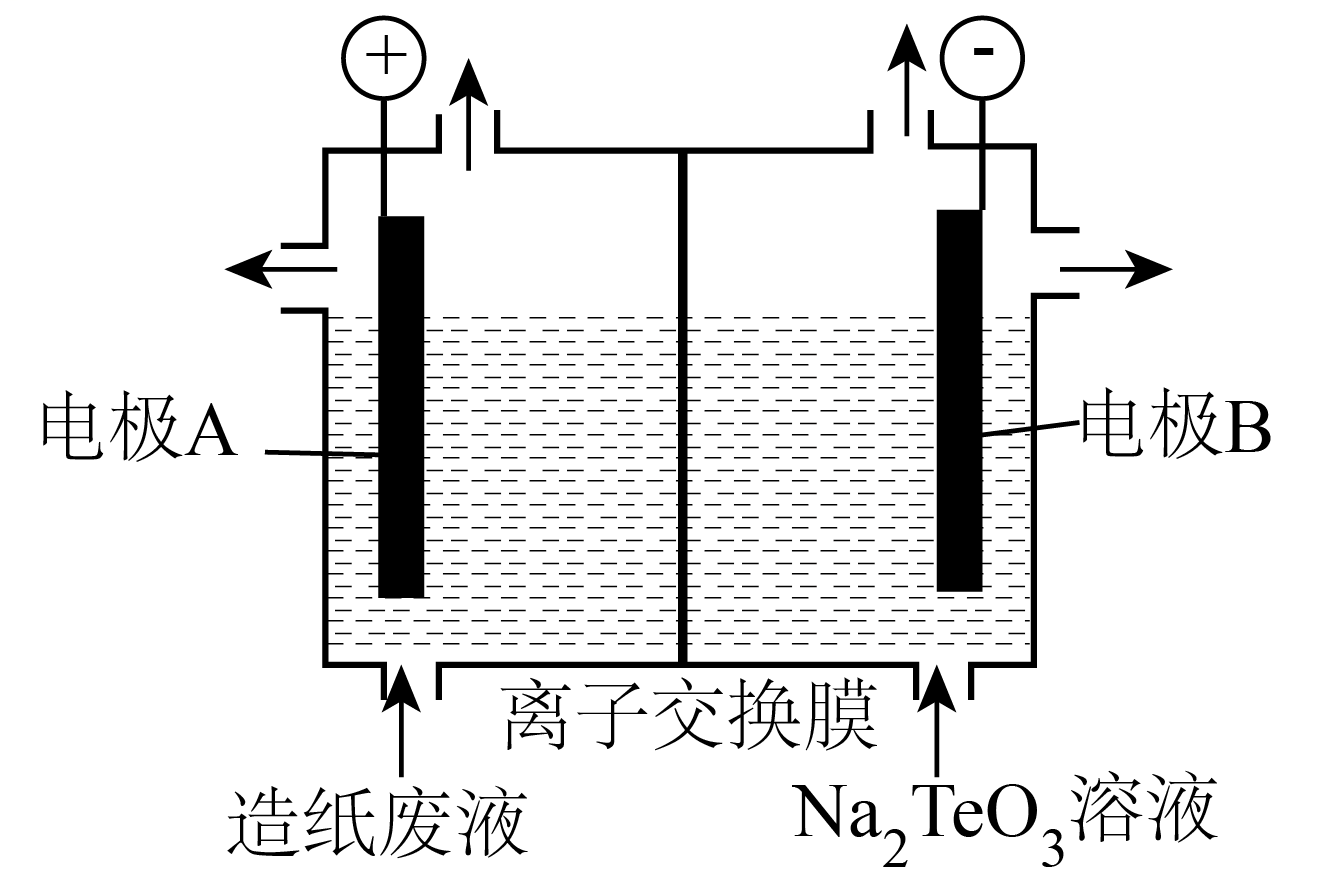
选项 | 实验 | 现象 | 结论 |
A | 向两份等体积等浓度的新制氯水中,分别滴加AgNO3溶液和淀粉KI溶液 | 前者产生白色沉淀,后者溶液变为蓝色 | 氯气与水的反应存在限度 |
B | 将苯与液溴在催化剂作用下产生的气体通入硝酸银溶液中 | 产生淡黄色沉淀 | 苯和液溴发生取代反应 |
C | 向1mL0.01mol·L-1MgCl2溶液中滴入2滴0.01mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.01mol·L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 向溶有SO2的CaCl2溶液中通入气体X | 产生白色沉淀 | X一定具有强氧化性 |

已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。