已知:与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
①配制480 mL 0.1 mol/L的标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、。
②将下述实验步骤A到F按实验过程先后次序排列。
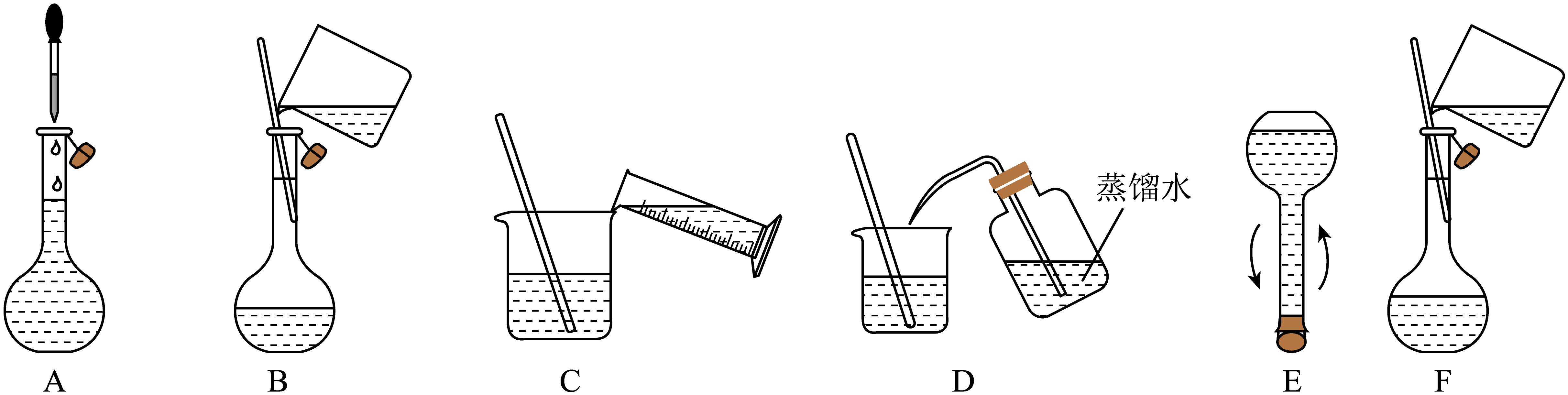
①用量取220.00 mL 0.017 mol/L 溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是。
③如何判定滴定结束?。
④列式并计算标准溶液
![]() 浓度。
浓度。
| KI溶液 | ||
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?。
②写出溶液与KI反应的离子方程式。
提出问题:与
是可逆反应,
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出与
反应的离子方程式:。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用溶液进行标定,发现消耗的
溶液体积相同。
实验小结:是否会影响滴定:。
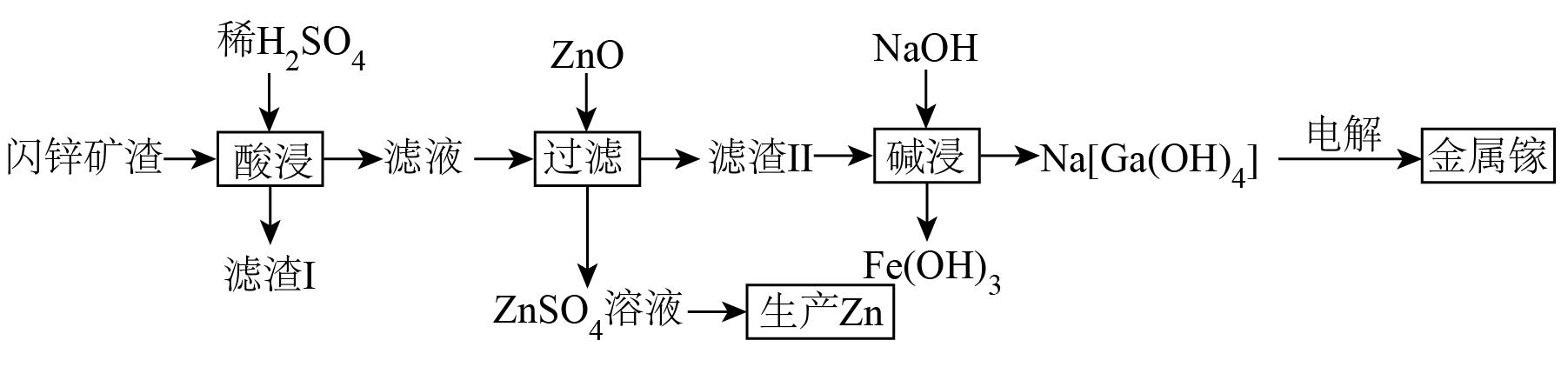
已知:①金属镓在化学性质上非常接近金属铝,其单质、氧化物和氢氧化物均有两性;
②闪锌矿渣通常含有 ,
、
, 硅酸盐等杂质;
③25℃时,、
。
回答下列问题:
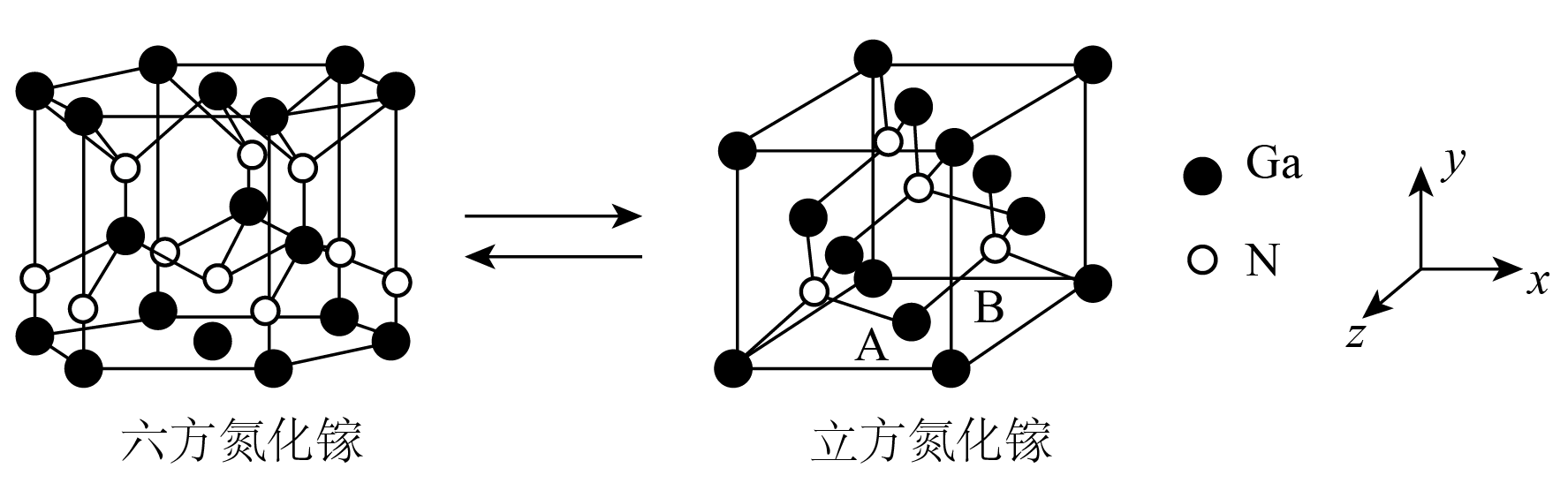
①六方氮化镓晶体硬度极高,熔点为1700℃,其高温熔融物不导电。六方氮化镓属于晶体。
②写出六方氮化镓晶胞的组成:。
②若立方氮化镓的边长为a nm,则其密度为(列出计算式)。