下列有关图示分析正确的是( )


①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
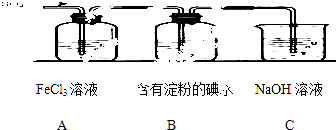
①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是.
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为 . |
(2)称量Na2CO3固体 | 称量过程中应用到的主要仪器是 . |
(3)将Na2CO3加入100mL烧杯中,加入适量蒸馏水 | 为了加快溶解速率,常采取的措施是 . |
(4)将烧杯中的溶液转移至仪器A(已检查不漏水)中 | ①在转移Na2CO3溶液前应将溶液 ; ②仪器A是 ; ③为防止溶液溅出,应采取的措施是 . |
(5)向仪器A中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 . |
(6)摇匀、装瓶,操作B,最后清洁、整理 | 操作B是 . |
讨论按上述步骤配制的Na2CO3溶液的浓度 (选填“是”或“不是”)0.200mol•L﹣1 . 理由是 .

