A.冷水浸泡 | B.加热煎制 | C.箅渣取液 | D.灌装保存 |
| | | |
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
(i)所需浓H2SO4的体积为(用下一小题的仪器量取).
(ii)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(iii)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌.
(iv)将的上述溶液沿玻璃棒注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀.
(v)加水至距刻度线1﹣2cm时,改用加水,使溶液凹液面跟刻度相平.
(vi)用“偏高”“偏低”或“无影响”填空:
①定容时,观察液面俯视:;
②摇匀后,液面低于刻度线,没有再加水:;
③取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:.
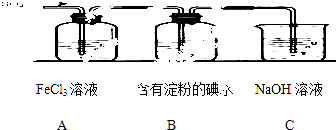
①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是.
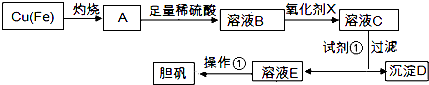
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答: